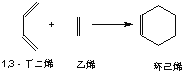
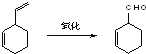
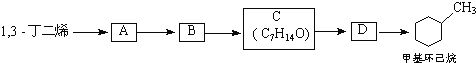
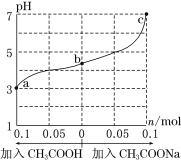
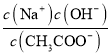��Ŀ����
����Ŀ�������������۵���Ҫ��Ⱦ��ΪPM10��PM2.5��SO2��NO2��O3��CO�����ʣ����У�NO2��SO2�����γ��������Ҫ���ʣ���һ�������£������ܷ�����Ӧ��NO2��g��+SO2��g��SO3��g��+NO��g��
���������գ�
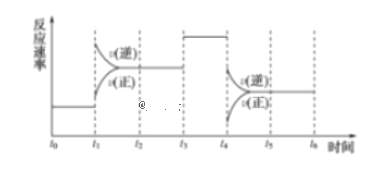
(1)��һ�������£��������ʵ�����NO2��SO2������������̶����ܱ������з�����Ӧ��������˵����Ӧ�Ѿ��ﵽƽ��״̬����______��
a��v��NO2������=v��SO2������ b�����������ԭ�Ӹ������ٸı�
c��������������ɫ���ٸı� d������������ƽ����Է����������ٸı�
(2)��������ͬʱ����NO2��SO2ʱ��SO2������ת���H2SO4����ԭ����______��
(3)��ѧ�������о����ô�������NO2��COת�������CO2��N2����Ӧ�Ļ�ѧ����ʽ��2NO2��g��+4CO��g��![]() 4CO2��g��+N2��g��+Q��Q��0���������ܱ������г���NO2��CO�����д�ʩ�����NO2ת���ʵ���______��
4CO2��g��+N2��g��+Q��Q��0���������ܱ������г���NO2��CO�����д�ʩ�����NO2ת���ʵ���______��
A��ѡ�ø�Ч���� B������NO2C�������¶� D����ѹ
(4)��д��Nԭ���������ӹ������ʽ______��д��CO2�ĵ���ʽ______��
(5)����S��N��O��C����Ԫ�ص�������ȷ����______��
A����̬�⻯���Ϊ���Է��� B������ϼ۾�����ԭ������������
C������һ��Ϊ���Ӿ��� D��ԭ�������������ֲ�ͬ��״�ĵ�����
(6)д��һ���ܹ��Ƚ�SԪ�غ�CԪ�طǽ�����ǿ���Ļ�ѧ��Ӧ����ʽ��______��
���𰸡�a c NO2���������� CD ![]()
![]() D 2NaHCO3+H2SO4�TNa2SO4+2H2O+2CO2��
D 2NaHCO3+H2SO4�TNa2SO4+2H2O+2CO2��
��������
(1)a��v��NO2������=v��SO2������=v��SO2�����������淴Ӧ������ȣ�
b���ӷ�Ӧ��ʼ���������ԭ�Ӹ���һֱ���ٸı䣻
c��������������ɫ���ٸı䣬˵������������Ũ�Ȳ��䣻
d������������ƽ����Է�������һֱ���ٸı䣻
(2)����������SO2ת���H2SO4����Ӧ������NO2��ɲ��䣻
(3)A��ѡ�ø�Ч������ƽ�ⲻ�ƶ���
B������NO2��ƽ�������ƶ���������ת���ʽ��ͣ�
C�������¶ȣ�ƽ�������ƶ���
D����ѹ��ƽ�������ƶ���
(4)����Nԭ�����������Ų�����д���������ʽ������8�����ȶ��ṹ����д��CO2�ĵ���ʽ��
(5)A������Ϊ�Ǽ��Է��ӣ�
B���������ۣ�
C�����ʯΪԭ�Ӿ��壻
D��ԭ����������s��p���ֲ�ͬ��״�ĵ����ƣ�
(6)������ǿ������ԭ��������������Ӧˮ���������Խǿ��Ԫ�طǽ�����Խǿ����������ǿ��̼�ᣬ�Դ���д��Ӧ����ʽ��
(1)a��v��NO2������=v��SO2������=v��SO2�����������淴Ӧ������ȣ���ƽ��״̬��a�������⣻
b���ӷ�Ӧ��ʼ���������ԭ�Ӹ���һֱ���ٸı䣬b�������⣻
c��������������ɫ���ٸı䣬˵������������Ũ�Ȳ��䣬��Ӧ��ƽ��״̬��c�������⣻
d������������ƽ����Է�������һֱ���ٸı䣬��d�������⣻
��ѡac����Ϊ��ac��
(2)����������SO2ת���H2SO4��������ã��ʴ�Ϊ��NO2���������ã�
(3)A��ѡ�ø�Ч������ƽ�ⲻ�ƶ�������������ת���ʲ��䣬��A �������⣻
B������NO2��ƽ�������ƶ���������ת���ʽ��ͣ���B�������⣻
C�������¶ȣ�ƽ�������ƶ�����������ת�������ߣ���C�������⣻
D����ѹ��ƽ�������ƶ�����������ת�������ߣ���D�������⣻
��ѡCD����Ϊ��CD��
(4)Nԭ���������ӹ������ʽΪ![]() ��CO2�ĵ���ʽΪ��
��CO2�ĵ���ʽΪ��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��![]() ��
��
(5)A������Ϊ�Ǽ��Է��ӣ���A��ѡ��
B���������ۣ���B��ѡ��
C�����ʯΪԭ�Ӿ��壬��C��ѡ��
D��ԭ����������s��p���ֲ�ͬ��״�ĵ����ƣ���Dѡ��
��ѡD����Ϊ��D��
(6)����ǿ����������������Ӧˮ���������Խǿ��Ԫ�طǽ�����Խǿ����������ǿ��̼�ᣬ��Ӧ����ʽ2NaHCO3+H2SO4�TNa2SO4+2H2O+2CO2������Ϊ��2NaHCO3+H2SO4�TNa2SO4+2H2O+2CO2����

 ����ͼ���������������ϵ�д�
����ͼ���������������ϵ�д�����Ŀ��![]() ����ͪ��һ����Ҫ���л�����ԭ�ϡ�ʵ���Һϳɻ���ͪ�ķ�Ӧ���£�
����ͪ��һ����Ҫ���л�����ԭ�ϡ�ʵ���Һϳɻ���ͪ�ķ�Ӧ���£�

�������ͻ���ͪ�IJ����������ʼ��±���
���� | ��Է������� | �е�(��) | �ܶ�(g��cm��3��20��) | �ܽ��� |
������ | 100 | 161.1 | 0.9624 | ������ˮ���� |
����ͪ | 98 | 155.6 | 0.9478 | ����ˮ���������� |
����20 mL������������Na2Cr2O7������Ļ��Һ��ַ�Ӧ���Ƶ���Ҫ������ͪ��ˮ�Ĵֲ�Ʒ��Ȼ����з����ᴿ�������ᴿ�������漰����Ҫ����(δ����)��
a.����ȥ���Ѻ��ռ�151��156����֣�
b.ˮ��������(���ѷе�34.6 ������ȼ��)��ȡ����ȡҺ�����л��㣻
c.���ˣ�
d.��Һ���м���NaCl���������ͣ����ã���Һ��
e.������ˮMgSO4���壬��ȥ�л���������ˮ��
�ش��������⣺
(1)���������ᴿ�������ȷ˳����__________ (����ĸ)��
(2)b��ˮ����������ȡ��Ŀ����_______��
(3)���¹�����ȡ��Һ�����������У�����ȷ����__________��
A.ˮ��Һ�м������ѣ�ת������Һ©���У����ϲ���������ͼ������
B.���κ����Һ©���ϿڵIJ���������
C.���������������ֳַ�Һ©�����ô�Һ��ֲ�
D.��Һʱ�����Ƚ��Ͽڲ������������ϵİ��۶�©�����ϵ�С�ף��ٴ��������²�Һ��ȫ������ʱ���ٴ��Ͽڵ����ϲ�Һ��
(4)����������d�У�����NaCl�����������__________����������ѵIJ����в��õļ��ȷ�ʽΪ________��
(5)�������ʱ��һ��ʱ�����δͨ����ˮ��Ӧ��ȡ����ȷ������______��
����Ŀ��ʵ�����Ʊ����ᶡ���Ļ����¶ȣ���Ӧ�¶ȣ���115��125�棬�����й��������±��������¹���ʵ�����Ʊ����ᶡ��������������ǣ�������
���� | ���� | 1-���� | ���ᶡ�� | 98%Ũ���� |
�е� | 117.9�� | 117.2�� | 126.3�� | 338.0�� |
�ܽ��� | ��Һˮ���л��� | ��Һˮ���л��� | ����ˮ����Һ�л��� | ��ˮ��� |
A.��Լ�����������1�����������ʵ���֮��Ӧ����1��1
B.����ˮԡ��������Ϊ���ᶡ���ķе����100��
C.�ӷ�Ӧ������������Ʒ�ķ�������Na2CO3��Һϴ�Ӻ��Һ
D.�ɴ�Ʒ�ƾ�Ʒ��Ҫ���е�һ������������ˮ������