题目内容
Ⅰ.化学实验室制取氯化氢气体的方法之一是将浓硫酸滴入浓盐酸中。请从下图中挑选所需仪器,在方框内画出用该方法制备、收集干燥氯化氢气体的装置简图,并在图中标明所用试剂。(仪器可重复使用,固定装置不必画出)
|
Ⅱ.实验室制备少量硫酸亚铁晶体的实验步骤如下:取过量洁净的铁屑,加入20%—30%的稀硫酸溶液,在50℃—80℃水浴中加热至不再产生气泡。将溶液趁热过滤,滤液移至试管中,用橡胶塞塞紧试管口,静置、冷却一段时间后收集产品。
(1)写出该实验制备硫酸亚铁的化学方程式:__________________________________。
(2)硫酸溶液过稀会导致_________________________________________________。
(3)采用水浴加热的原因是__________________________________________________。
(4)反应时铁屑过量的目的是(用离子方程式表示)____________________________。
(5)溶液趁热过滤的原因是______________________。塞紧试管口的目的是__________________________。
(6)静置冷却一段时间后,在试管中观察到的现象是_____________________________。
Ⅰ.
(1)

Ⅱ.
(1)Fe+H2SO4(稀)![]() FeSO4+H2↑
FeSO4+H2↑
(2)反应速率慢,不利于晶体析出
(3)容易控制温度
(4)Fe+2Fe3+![]() 3Fe2+
3Fe2+
(5)减少FeSO4的损失 防止空气进入试管将Fe2+氧化为Fe3+
(6)有浅绿色晶体析出
解析:Ⅰ.实验室用浓H2SO4滴入浓盐酸中制取氯化氢,结合反应物状态、反应条件及产物的性质和题目要求设计实验装置图。
Ⅱ.根据题干信息“洁净的铁屑中加入20%—30%的稀H2SO4”写出其反应化学方程式为:Fe+H2SO4(稀) ![]() FeSO4+H2↑。若硫酸溶液过稀,会导致反应速率变慢,而不利于晶体的析出。反应过程中采用水浴加热的目的是为了便于控制温度,反应过程中加入过量铁屑的目的是防止生成Fe3+,即发生反应:2Fe3++Fe
FeSO4+H2↑。若硫酸溶液过稀,会导致反应速率变慢,而不利于晶体的析出。反应过程中采用水浴加热的目的是为了便于控制温度,反应过程中加入过量铁屑的目的是防止生成Fe3+,即发生反应:2Fe3++Fe![]() 3Fe2+。反应后的溶液趁热过滤,是为了防止冷却时FeSO4晶体析出而导致FeSO4损失;用橡胶塞塞紧试管口的目的是为了防止空气进入试管中将Fe2+氧化为Fe3+而导致其变质。当静置冷却一段时间后,在试管中观察到的现象为有浅绿色晶体析出。
3Fe2+。反应后的溶液趁热过滤,是为了防止冷却时FeSO4晶体析出而导致FeSO4损失;用橡胶塞塞紧试管口的目的是为了防止空气进入试管中将Fe2+氧化为Fe3+而导致其变质。当静置冷却一段时间后,在试管中观察到的现象为有浅绿色晶体析出。

 步步高达标卷系列答案
步步高达标卷系列答案

 5NaC1+NaC1O3+3H2O,今在—5℃的NaOH溶液中通入适量C12(平衡常数K=1.09×1012),此时C12的氧化产物主要是 ;将溶液加热,溶液中主要离子浓度随温度的变化如右图所示,图中A、B、C依次表示的离子是 。
5NaC1+NaC1O3+3H2O,今在—5℃的NaOH溶液中通入适量C12(平衡常数K=1.09×1012),此时C12的氧化产物主要是 ;将溶液加热,溶液中主要离子浓度随温度的变化如右图所示,图中A、B、C依次表示的离子是 。
 NaC1O3+3H2↑
NaC1O3+3H2↑ HC1O+H++C1—
HC1O
HC1O+H++C1—
HC1O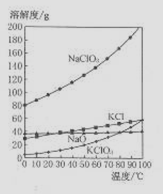
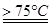 5NaC1+NaC1O3+3H2O,今在—5℃的NaOH溶液中通入适量C12(平衡常数K=1.09×1012),此时C12的氧化产物主要是 ;将溶液加热,溶液中主要离子浓度随温度的变化如右图所示,图中A、B、C依次表示的离子是 。
5NaC1+NaC1O3+3H2O,今在—5℃的NaOH溶液中通入适量C12(平衡常数K=1.09×1012),此时C12的氧化产物主要是 ;将溶液加热,溶液中主要离子浓度随温度的变化如右图所示,图中A、B、C依次表示的离子是 。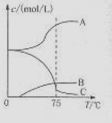
 NaC1O3+3H2↑
NaC1O3+3H2↑ HC1O+H++C1— HC1O
HC1O+H++C1— HC1O