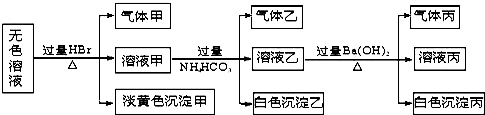
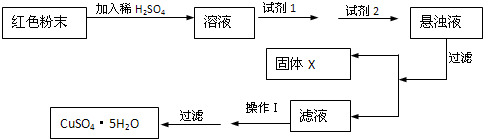
题目内容
将0.01mol的NaHCO3加入0.1mol?L-1、50mL H2SO4溶液中,充分反应后向混合液中加入1.22g的BaCl2?xH2O,Ba2+完全沉淀,则x的值不可能是( )
| A、1 | B、2 | C、3 | D、4 |
考点:化学方程式的有关计算
专题:计算题
分析:首先由硫酸的浓度和体积求出硫酸的物质的量,然后根据关系式:H2SO4~BaCl2?xH2O,由物质的量求摩尔质量.
解答:
解:n( H2SO4)=10-3L/mL×50mL×0.1mol?L-1=5×10-3mol,Ba2+完全沉淀,所以硫酸离子是足量的,即18x+208≥
,则x≥2.22的正整数,故选A.
| 1.22g |
| 5×10-3mol |
点评:本题考查物质的量浓度有关计算等,比较基础,注意根据化学方程式解答.

练习册系列答案
相关题目
如图装置进行电解实验,下列说法正确的是( )


| A、电解过程中铜电极上有O2产生 | ||||
| B、整个电解过程中,溶液pH不断减小 | ||||
| C、整个电解过程中,石墨电极上一直产生H2 | ||||
D、电解初期,主反应方程式为:Cu+H2SO4
|
在A、B、C三试管中分别盛有Cl-、Br-、I- 的溶液,向A试管中加入新制的氯水和CCl4,出现分层,下层为橙红色,再将此溶液倒入C试管中,无变化,则A、B、C三支试管中所盛有的离子依次是( )
| A、I-、Br-、Cl- |
| B、Br-、I-、Cl- |
| C、Cl-、I-、Br- |
| D、Br-、Cl-、I- |
科学家用氘盐酸(DCl)和重水(D2O)溶液处理样品,对收集的气体加以分析,结果只发现有一些气体状态的碳氘化合物.这个实验不能用普通盐酸,其理由是( )
| A、普通盐酸的酸性太强 |
| B、普通盐酸具有挥发性 |
| C、普通盐酸和月球岩石中的碳化物无法反应 |
| D、无法区别岩石中原来含有的是含碳而不含普通氢的化合物,还是含碳和普通氢的化合物 |
下列反应属于吸热反应的是( )
| A、稀硫酸与氢氧化钾溶液反应 |
| B、氢氧化钡晶体与氯化铵晶体研磨搅拌的反应 |
| C、锌与稀硫酸的反应 |
| D、生石灰变成熟石灰的反应 |
已知1g氢气完全燃烧生成水蒸气时放出热量121kJ,且氧气中1mol O=O键完全断 裂时吸收热量496kJ,氢气中1mol H-H键断裂时吸收热量为436kJ,求水蒸气中1mol H-O键形成时放出热量( )
| A、463kJ |
| B、557kJ |
| C、486kJ |
| D、188kJ |
如图是立方烷的球棍模型,下列有关说法不正确的是( )
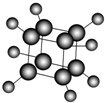

| A、其一氯代物只有一种 |
| B、其二氯代物有三种 |
| C、分子中σ键均由sp3-s电子云重叠而成 |
| D、它与苯乙烯(C6H5-CH=CH2)互为同分异构体 |