题目内容
【题目】电浮选凝聚法是工业上采用的一种污水处理方法,某研究小组用电浮选凝聚法处理污水,设计装置如图所示,下列说法正确的是( ) 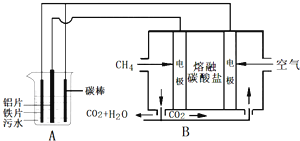
A.装置A中碳棒为阴极
B.装置B中通入空气的电极反应是O2+2H2O+4e-═4OH-
C.污水中加入适量的硫酸钠,既可增强溶液的导电性,又可增强凝聚净化的效果
D.标准状况下,若A装置中产生44.8L气体,则理论上B装置中要消耗CH4 11.2L
【答案】C
【解析】A装置为电解池,B装置为原电池装置,原电池工作时,通入甲烷的一级为负极,发生氧化反应,负极电极反应是CH4+4CO32--8e-=5CO2+2H2O,通入氧气的一极为正极,发生还原反应,正极反应为O2+2CO2+4e-=2CO32- , 电解池中Fe为阳极,发生Fe-2e-=Fe2+ , 阴极的电极反应为:2H++2e-=H2↑,二价铁离子具有还原性,能被氧气氧化到正三价,4Fe2++10H2O+O2=4Fe(OH)3↓+8H+ . A.电解池中Al片为阴极,碳棒、铁片和污水构成原电池,碳棒正极,故A错误;B.电池是以熔融碳酸盐为电解质,B中通入空气的电极是正极,反应式为:O2+2CO2+4e-=2CO32- , 故B错误;C.通过电解生成Fe(OH)3胶体可吸附污染物而沉积下来,加入硫酸钠能使导电能力增强,加快生成Fe(OH)3胶体速率,提高污水的处理效果,故C正确;D.A装置中阴极的电极反应为:2H++2e-=H2↑,阴极产生了44.8L(标准状况)即2mol的气体产生,但是碳棒为正极,正极上还可以以生成氧气,所以参加反应的甲烷大于11.2L,故D错误;故选C。

【题目】目前世界上60%的镁是从海水中提取的。已知海水提取镁的主要步骤如下:

(1)关于加入试剂①作沉淀剂,有以下几种不同方法,请完成下列问题。
方法 | 是否正确 | 简述理由 |
方法1:直接往海水中加入沉淀剂 | 不正确 | (一) |
方法2:高温加热蒸发海水后,再加入沉淀剂 | (二) | (三) |
你认为最合理的其他方法是: (四) | ||
(一)__________________________________________________;
(二)__________________________________________________;
(三)__________________________________________________;
(四)__________________________________________________。
(2)框图中加入的试剂①应该是________(填化学式);加入的试剂②是________(填化学式);工业上由无水MgCl2制取镁的化学方程式为___________。
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:

苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
按下列合成步骤回答问题:
(1)在a中加入15 mL无水苯和少量铁屑。在b中小心加入4.0 mL液态溴。向a中滴入几滴溴,有白色烟雾产生,是因为生成了________气体;继续滴加至液溴滴完;装置d的作用是________________。
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL 10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用是_______________________________________________________;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是____________________________________________ 。
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为______,要进一步提纯,下列操作中可行的是________(填字母)。
A.重结晶 B.过滤
C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是________(填字母)。
A.25 mL B.50 mL
C.250 mL D.500 mL