题目内容
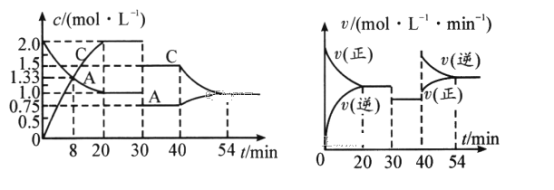
【题目】某温度下,将Cl2通入NaOH溶液中,反应得到NaClO、NaClO3的混合液,经测定ClO-和ClO3-的物质的量浓度之比为1∶3,则Cl2与NaOH溶液反应时被还原的氯原子与被氧化的氯原子的物质的量之比为
A.21∶5B.11∶3C.3∶1D.4∶1
【答案】D
【解析】
化合价升高的元素被氧化,化合价降低的元素被还原,Cl2被氧化生成ClO与ClO3,Cl2还原有生成NaCl,ClO与ClO3的离子个数比为1:3,假设ClO与ClO3的物质的量分别为1mol、3mol,根据电子转移守恒,ClO的物质的量=![]() =16mol,根据Cl原子守恒,被还原的氯原子与被氧化的氯原子的个数比=16mol:(3mol+1mol)=4:1,
=16mol,根据Cl原子守恒,被还原的氯原子与被氧化的氯原子的个数比=16mol:(3mol+1mol)=4:1,
答案选D。

练习册系列答案
相关题目