题目内容
把48.5g锌铜合金投入足量盐酸中,恰好完全反应,得到1g H2.试计算:
(1)该合金中锌的质量;
(2)该合金中锌、铜的物质的量之比.(必须书写计算过程,没有书写不给分)
(1)该合金中锌的质量;
(2)该合金中锌、铜的物质的量之比.(必须书写计算过程,没有书写不给分)
考点:化学方程式的有关计算
专题:计算题
分析:(1)铜不与盐酸反应,锌与盐酸反应生成氢气,根据n=
计算出氢气的物质的量,再根据反应方程式Zn+2HCl═ZnCl2+H2↑计算出锌的物质的量及质量;
(2)根据合金的总质量、锌的质量计算出铜的质量,根据n=
计算出铜的质量,再计算出锌、铜的物质的量之比.
| m |
| M |
(2)根据合金的总质量、锌的质量计算出铜的质量,根据n=
| m |
| M |
解答:
解:(1)把48.5g锌铜合金投入足量盐酸中,铜不与盐酸反应,氢气为锌与盐酸反应生成的,1g氢气的物质的量为:n=
=
=0.5mol,
根据反应方程式Zn+2HCl═ZnCl2+H2↑可知,生成0.5mol氢气消耗锌的物质的量为:0.5mol,
需要锌的质量为:65g/mol×0.5mol=32.5g,
答:合金中锌的质量为32.5g;
(2)48.5g锌铜合金中含有32.5g锌,则含有铜的质量为:48.5g-32.5g=16g,
16g铜的物质的量为:n(Cu)=
=
=0.25mol,
则合金中锌、铜的物质的量之比为:0.5mol:0.25mol=2:1,
答:该合金中锌、铜的物质的量之比为2:1.
| m |
| M |
| 1g |
| 2g/mol |
根据反应方程式Zn+2HCl═ZnCl2+H2↑可知,生成0.5mol氢气消耗锌的物质的量为:0.5mol,
需要锌的质量为:65g/mol×0.5mol=32.5g,
答:合金中锌的质量为32.5g;
(2)48.5g锌铜合金中含有32.5g锌,则含有铜的质量为:48.5g-32.5g=16g,
16g铜的物质的量为:n(Cu)=
| m |
| M |
| 16g |
| 64g/mol |
则合金中锌、铜的物质的量之比为:0.5mol:0.25mol=2:1,
答:该合金中锌、铜的物质的量之比为2:1.
点评:本题考查了混合物反应的计算,题目难度不大,注意掌握物质的量与摩尔质量等物理量之间的关系,明确反应原理为解答本题的关键.

练习册系列答案
相关题目
下列溶液中,各关系式正确的是( )
| A、等浓度、等体积的NaOH 和二元弱酸H2A 混和溶液中:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-) |
| B、1 L 0.1 mol?L-1 CuSO4?(NH4)2SO4?6H2O 的溶液中:c(NH4+)>c(SO42-)>c(Cu2+)>c(H+)>c(OH-) |
| C、物质的量浓度相等的Na2CO3 和NaHCO3 溶液等体积混合后的溶液中:3c(H2CO3)+2c(H+)+c(HCO3-)=2c(OH-)+c(CO32-) |
| D、已知两种弱酸HA、HB 的电离平衡常数Ka(HA)>Ka(HB),常温下0.1 mol?L-1的HA、HB、NaA、NaB 溶液中:pH(NaA)>pH(NaB)>pH(HA)>pH(HB) |
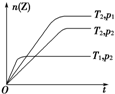 反应2X(g)+Y(g)?2Z(g),△H<0在不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量n与反应时间t的关系如图所示.下列判断正确的是( )
反应2X(g)+Y(g)?2Z(g),△H<0在不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量n与反应时间t的关系如图所示.下列判断正确的是( )| A、T1<T2,p1<p2 |
| B、T1<T2,p1>p2 |
| C、T1>T2,p1>p2 |
| D、T1>T2,p1<p2 |
若测得盐酸和氢氧化钠溶液反生成18g水时放出的热量为Q,则下列各反应在溶液中生成18g水时,放出的热量也为Q的是( )
①醋酸和氢氧化钠溶液;
②氨水和盐酸;
③氢氧化钾溶液和硝酸.
①醋酸和氢氧化钠溶液;
②氨水和盐酸;
③氢氧化钾溶液和硝酸.
| A、①②③ | B、①③ | C、②③ | D、③ |
下列过程或现象与盐类水解无关的是( )
| A、纯碱溶液去油污 |
| B、铁在潮湿的环境下生锈 |
| C、向氯化铁溶液中滴入氢氧化钠溶液产生红褐色沉淀 |
| D、浓硫化钠溶液有臭味 |
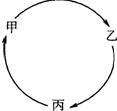 甲、乙、丙三种物质有如图所示的转化关系.
甲、乙、丙三种物质有如图所示的转化关系.