题目内容
某透明溶液,可能含有(大量存在)下面离子的几种:(阳离子组:Cu2+、Ba2+、Mg2+、H+;阴离子组:Cl-、OH-、N
、C
),已知该溶液能和铝粉反应放出氢气.
(1)如果确定该溶液中含有Mg2+,试推断溶液中一定还含有______离子.
(2)如果确定该溶液中含有OH-,则溶液中一定还含有______.
| O | -3 |
| O | 2-3 |
(1)如果确定该溶液中含有Mg2+,试推断溶液中一定还含有______离子.
(2)如果确定该溶液中含有OH-,则溶液中一定还含有______.
溶液能和铝粉反应放出氢气,为酸或强碱溶液,
(1)该溶液中含有Mg2+,该溶液为酸溶液,一定存在H+,因H+与OH-结合生成水,与NO3-结合具有强氧化性不生成氢气,与CO32-结合生成水和气体,则不能共存,又溶液不显电性,一定存在阴离子,则一定有Cl-,故答案为:H+、Cl-;
(2)该溶液中含有OH-,该溶液为强碱溶液,OH-能分别与Cu2+、Mg2+、H+反应,则一定存在Ba2+,故答案为:Ba2+.
(1)该溶液中含有Mg2+,该溶液为酸溶液,一定存在H+,因H+与OH-结合生成水,与NO3-结合具有强氧化性不生成氢气,与CO32-结合生成水和气体,则不能共存,又溶液不显电性,一定存在阴离子,则一定有Cl-,故答案为:H+、Cl-;
(2)该溶液中含有OH-,该溶液为强碱溶液,OH-能分别与Cu2+、Mg2+、H+反应,则一定存在Ba2+,故答案为:Ba2+.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
某透明溶液仅可能含有下列离子中的几种:Fe3+、NH4+、Mg2+、Ba2+、NO3-、HCO3-、SO42-、S2O32-.将该溶液分成三等份,进行如下实验:
①在第一份溶液中加入足量稀盐酸,得到无色溶液同时产生无色气体和3.2g淡黄色沉淀.
②在第二份溶液中加入足量的氢氧化钠溶液,得到白色沉淀,溶液充分加热后产生的气体可使湿润的红色石蕊试纸变蓝.
③在第三份溶液中加入足量的稀硝酸和氯化钡溶液,最终得到69.9g白色沉淀.
已知:8NO3-+2H++3S2O32-=6SO42-+8NO↑+H2O
下列说法不正确的是( )
①在第一份溶液中加入足量稀盐酸,得到无色溶液同时产生无色气体和3.2g淡黄色沉淀.
②在第二份溶液中加入足量的氢氧化钠溶液,得到白色沉淀,溶液充分加热后产生的气体可使湿润的红色石蕊试纸变蓝.
③在第三份溶液中加入足量的稀硝酸和氯化钡溶液,最终得到69.9g白色沉淀.
已知:8NO3-+2H++3S2O32-=6SO42-+8NO↑+H2O
下列说法不正确的是( )
| A、仅由实验①可得出的结论是:原溶液中含S2O32-不含Fe3+、NO3- | B、原溶液中肯定存在的离子是:S2O32-、NH4+、Mg2+、SO42- | C、不能确定是否存在的离子是:HCO3-和SO42- | D、实验③得到白色沉淀为BaSO4 |
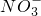 、
、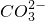 ),已知该溶液能和铝粉反应放出氢气.
),已知该溶液能和铝粉反应放出氢气.