题目内容
改变反应条件使化学平衡向正反应方向移动,下列判断正确的是
- A.生成物浓度一定增大
- B.生成物的物质的量分数一定增大
- C.反应物转化率一定提高
- D.某生成物的产率可能提高
试题分析:该题的化学反应未给出,而使化学平衡向正反应方向移动的措施是多种多样的,但具体措施也未给出,因此,选项中“一定”是错误的,“可能”是正确的,即答案选D。
考点:考查外界条件平衡状态的影响
点评:该题是中等难度的试题,试题灵活性强,注重能力的考查和解决方法的训练。有利于提高学生分析问题、解决问题的能力。

在一定体积的密闭容器中,进行如下化学反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),其化学平衡常数K和温度t的关系如下表:
CO2(g)+H2(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=_____________________________,该反应为_______________反应(选吸热或放热)。
若改变条件使平衡向正反应方向移动,则平衡常数_________(填序号)
①一定不变 ②一定减小 ③可能增大 ④增大、减小、不变皆有可能
(2)能判断该反应是否达到化学平衡状态的依据是___________
(a)容器中压强不变 (b)混合气体中c(CO)不变
(c)v逆(H2)=v正(H2O) (d)c(CO)=c(CO2)
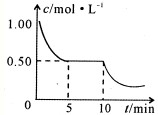
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
CO(g)+H2O(g) ![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度 /℃ | 起始量/mol | 平衡量/mo | 达到平衡 所需时间 /min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
实验1中以v(CO2) 表示的反应速率为 。实验2达到平衡所需时间比实验1所需时间短的原因是_________________________________________________________。
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)将水蒸气通过红热的炭即可产生水煤气。反应为:
C(s)+H2O(g)![]() CO(g)+H2(g) ΔH=131.3 kJ·mol-1
CO(g)+H2(g) ΔH=131.3 kJ·mol-1
能使反应速率加快的措施有__________(填序号)。
①增加C的物质的量
②升高反应温度
③随时吸收CO、H2转化为CH3OH
④密闭定容容器中充入CO(g)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下两组数据:
CO2(g)+H2(g),得到如下两组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 2 |
①实验1中以v(CO2)表示的反应速率为__________。
②该反应的逆反应为__________(填“吸”或“放”)热反应。
(3)在一容积为2 L的密闭容器内加入2 mol的CO和6 mol的H2,在一定条件下发生如下反应: CO(g)+2H2(g)![]() CH3OH(g) ΔH<0
CH3OH(g) ΔH<0
该反应的逆反应速率与时间的关系如图所示:

①由图可知反应在t1、t3、t7时都达到了平衡,而在t2、t8时都改变了条件,试判断t8时改变的条件可能是__________ 。
② 若t4时降压, t5时达到平衡,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系曲线。