题目内容
(08上海嘉定区期末)某化学课外兴趣小组探究铜与浓硫酸的反应情况。甲、乙、丙三位同学进行了下列实验:取12.8g铜片和20ml、18mol/L的浓硫酸放在圆底烧瓶中共热,直至反应完毕,最后发现烧瓶中还有铜片剩余外,同时根据所学的知识认为还有较多的硫酸剩余。(1)请写出铜跟浓硫酸反应的化学方程式:______________________________
试问:为什么较多的余酸不再与铜片继续反应?简述理由:_______________________________________________________________。
可以证明有余酸的实验方案是________(填写字母,错选或多选扣分)
(a)再加入铁粉 (b)再滴入BaCl2溶液 (c)再加入银粉(d)再滴入Na2CO3溶液
(2)甲学生设计求余酸浓度的实验方案是测定产生气体的量。其方法有多种,请问下列方案中不可行的是________(填写字母,错选或多选扣分)
(a)将产生的气体缓缓通过预先称量盛有碱石灰的干燥管,结束反应后再次称量。
(b)将产生的气体缓缓通入酸性高锰酸钾溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀。
(c)用排水法测定其产生气体的体积(折算成标准状况)。
(d)用排饱和NaHSO3溶液的方法测出其产生气体的体积(折算成标准状况)。
(3)乙同学设计测定余酸浓度的实验方案是:测定反应后的混合液中Cu2+的量。在反应后的溶液中加蒸馏水稀释至100ml,加入足量Na2S溶液,充分反应后,过滤、洗涤、干燥、称量沉淀。请写出生成沉淀的离子方程式:___________________________________
(4)根据甲、乙两同学的实验方案,除测算产生气体的物质的量或反应掉的铜的物质的量外,尚缺少的测量数据是_________________________________。
(5)丙同学提出甲、乙两同学的实验方案设计的复杂,为此他设计了下列较为简易的实验方案:取出反应后的铜片,进行洗涤、干燥、称量。若称得剩余铜片的质量为Wg,测得
反应后溶液的体积为Vml,请计算剩余硫酸的物质的量浓度
=______________________mol/L(用含W、V的代数式表示)
答案:
(1)Cu + 2H2SO4 ![]() CuSO4 + SO2↑+ 2H2O (2分) 反应中硫酸不断消耗,浓度变稀,铜片不再与稀硫酸反应(1分);a、d(2分);(2)a、c(2分);(3)
CuSO4 + SO2↑+ 2H2O (2分) 反应中硫酸不断消耗,浓度变稀,铜片不再与稀硫酸反应(1分);a、d(2分);(2)a、c(2分);(3)![]() (2分);(4)(烧瓶中)反应后溶液的体积(1分);
(2分);(4)(烧瓶中)反应后溶液的体积(1分);


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案2(08浙江省开化中学模拟)实验室中根据2SO2+O2![]() 2SO3;ΔH=-393.2 kJ?mol-1设计如下图所示实验装置来制备SO3固体。请回答下列问题。
2SO3;ΔH=-393.2 kJ?mol-1设计如下图所示实验装置来制备SO3固体。请回答下列问题。
 |
(1)实验前,必须进行的操作是(填操作名称,不必写具体过程)
(2)在A装置中加入Na2SO3固体的同时,还需加几滴水,然后再滴加浓硫酸。加几滴水的作用是
(3)小试管C的作用是
(4)广口瓶D内盛的试剂是 。装置D的三个作用是 ①
② ③
(5)实验中当Cr2O3表面红热时,应将酒精灯移开一会儿再加热,以防温度过高,这样做的原因是
(6)装置F中U型管内收集到的物质的颜色、状态是
(7)装置G的作用是
(8)从G装置导出的尾气处理方法是
(08皖南8校第三次联考)1 L某混合溶液,可能含有的离子如下表:
可能大量还有的阳离子 |
|
可能大量还有的阴离子 |
|
 (1)往该溶液中逐滴加入
(1)往该溶液中逐滴加入![]() 溶液并适当
溶液并适当
加热,产生沉淀和气体的物质的量(![]() )
)
与加入![]() 溶液的体积(V)的关系
溶液的体积(V)的关系
如右图所示。则该溶液中确定含有的离子
有_______________;不能确定是否含有
的阳离子有______________,要确定其存
在可补充做的实验是___________;肯定不存在的阴离子有_________________。
(2)经检测,该溶液中含有大量的![]() ,若向1 L该混合溶液中通入―定晕的
,若向1 L该混合溶液中通入―定晕的![]() ,溶液中
,溶液中![]() 的物质的量与通入
的物质的量与通入![]() 的体积(标准状况)的关系如下表所示,分析后回答下列问题:
的体积(标准状况)的关系如下表所示,分析后回答下列问题:

 (08安徽信息卷)2008年北京奥运会体现“人文奥运”的一个重要举措是坚决反对运动员服用兴奋剂。利尿酸足一种被禁止使用的药物,其结构简式如图所示。下列有关利尿酸说法正确的是()
(08安徽信息卷)2008年北京奥运会体现“人文奥运”的一个重要举措是坚决反对运动员服用兴奋剂。利尿酸足一种被禁止使用的药物,其结构简式如图所示。下列有关利尿酸说法正确的是()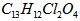
 溶液发生显色反应
溶液发生显色反应 。下列说法正确的是()
。下列说法正确的是() A.a极为电池的正极
A.a极为电池的正极
 厍仑的电量
厍仑的电量  ①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H1=+49.0KJ/mol
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H1=+49.0KJ/mol