题目内容
18.实验室用向上排空气法收集NO2气体,若用150mL的集气瓶收集了一定量的NO2后,将集气瓶倒置于盛满水的水槽里,充分作用后残留60mL气体,将集气瓶从水槽中取出,又见瓶中气体变成红棕色,据此推知收集的NO2气体的体积为(空气按体积比V(N2):V(O2)=4:1计,不考虑N2O4的生成)( )| A. | 50mL | B. | 72mL | C. | 78mL | D. | 100mL |
分析 可能发生的反应为:4NO2+O2+2H2O=4HNO3,3NO2+H2O=2HNO3+NO,试管中O2和NO2气体按体积比1:4混合全部溶解,由于将集气瓶从水槽中取出,又见瓶中气体变成红棕色,说明剩余气体为NO,先根据4NO2+O2+2H2O=4HNO3计算剩余二氧化氮体积,然后根据3NO2+H2O=2HNO3+2NO求出过量的NO2,进而计算总的NO2的体积.
解答 解:NO2和O2与水的反应属于循环反应,可简化为:4NO2+O2+2H2O=4HNO3,
由于将集气瓶从水槽中取出,又见瓶中气体变成红棕色,说明剩余气体为NO,
根据3NO2+H2O=2HNO3+NO可知,容器中残留60mL气体,说明剩余的为NO和空气中的氮气,设参加反应的O2气体体积为x,空气中N2和O2按体积比4:1计,剩余氮气为4x,
4NO2+O2+2H2O=4HNO3,3NO2+H2O=2HNO3+NO
4x x (150mL-4x-x-4x) $\frac{1}{3}$(150mL-9x)
$\frac{1}{3}$(150mL-9x)+4x=60mL,解得x=10mL,
则原混合气体中二氧化氮的体积为:4x+(150mL-4x-x-4x)=100mL,
故选D.
点评 本题考查了氮氧化物的性质、混合物有关计算,题目难度中等,合理判断反应后气体组成为解答关键,再结合反应的方程式计算,试题培养了学生的分析及化学计算能力.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案
相关题目
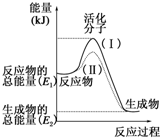
3.仅改变下列一个条件,通过提高活化分子的百分率来提高反应速率的是( )
| A. | 加热 | B. | 加压 | C. | 加负催化剂 | D. | 加大反应物浓度 |
10.硒是人体肝脏和肾脏的组成元素之一,现在含有元素硒(Se)的保健品已经进入市场,已知它与氧元素同主族,与K同周期,关于硒的说法中不正确的是( )
| A. | 原子序数为34 | B. | 还原性:H2Se<H2S | ||
| C. | 酸性:H2SeO4<HBrO4 | D. | 稳定性:H2Se>AsH3 |
8.区别棉花和羊毛最简便的方法是( )
| A. | 加稀硫酸水解 | B. | 浸入水中 | C. | 加入碘水 | D. | 火上灼烧闻气味 |
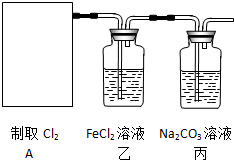
 请认真观察如图,然后回答问题.
请认真观察如图,然后回答问题.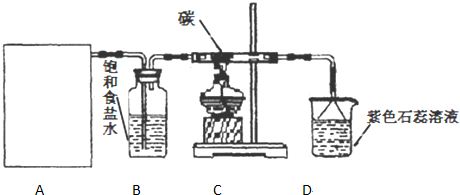
 (R,R′代表烃基)
(R,R′代表烃基) ,M的结构式
,M的结构式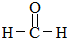 .
. .
.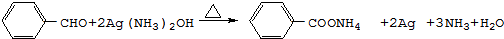 .
.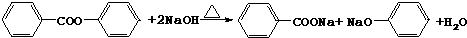 .
.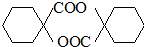 ,其它无机试剂任选.
,其它无机试剂任选.