题目内容
下图曲线a和b是盐酸与氢氧化钠溶液相互滴定的曲线,下列叙述正确的是
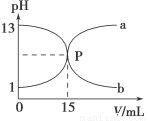
A.盐酸的物质的量浓度为1 mol·L-1
B.P点时反应恰好完全,溶液呈中性
C.曲线a是盐酸滴定氢氧化钠溶液的滴定曲线
D.酚酞不能用作本实验的指示剂
B
【解析】
试题分析:A、根据曲线可以看出盐酸溶液的pH=1,pH=-lgC(H+)=1,所以C(HCl)=C(H+)=0.1mol/L,错误;B、根据曲线可以看出P点时pH=7,说明溶液呈中性,反应恰好完全,正确;C、曲线a的pH是由小到大,说明是氢氧化钠溶液滴定盐酸溶液的曲线,错误;D、氢氧化钠与盐酸恰好反应时溶液呈中性,可用酚酞或甲基橙做指示剂,错误;选B。
考点:考查酸碱中和滴定。

 名校课堂系列答案
名校课堂系列答案(10分)请回答下列问题:
(1)CH4和H2O在催化剂表面发生反应CH4+H2O(g)? CO+3H2,该反应在不同温度下的化学平衡常数如下表:
CO+3H2,该反应在不同温度下的化学平衡常数如下表:
温度/℃ | 800 | 1 000 | 1 200 | 1 400 |
平衡常数 | 0.45 | 1.92 | 276.5 | 1 771.5 |
①该反应是________(填“吸热”或“放热”)反应
②T ℃时,向1 L密闭容器中投入1 mol CH4和1 mol H2O(g),5小时后测得反应体系达到平衡状态,此时c(CH4)=0.5 mol·L-1,计算该温度下CH4+H2O(g) CO+3H2的平衡常数K=______,该温度下达到平衡时H2的平均生成速率为_______________
CO+3H2的平衡常数K=______,该温度下达到平衡时H2的平均生成速率为_______________
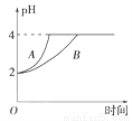
(2)常温下,取pH=2的盐酸和醋酸各100 mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸pH变化曲线的是________(填“A”或“B”)。设盐酸中加入的Zn粒质量为m1,醋酸中加入的Zn粒质量为m2。则m1________m2(填“<”、“=”或“>”)。