题目内容
下列叙述正确的是
- A.0.1 mol·L-1NH4Cl溶液:c(NH4+)=c(Cl-)
- B.在25℃时,pH=4的盐酸与pH=10的氨水溶液等体积混合后pH>7
- C.0.1 mol·L-1与0.2 mol·L-1氨水溶液中c(OH-)之比为1︰2
- D.中和pH与体积都相同的氨水和Ba(OH)2溶液,消耗HCl的物质的量之比是1∶2
B
本题考查强弱电解质的电离及盐的水解问题。A项NH4Cl溶液呈酸性,NH4+要水解,所以c(NH4+)<c(Cl-),错误;B项因为氨水是弱电解质还可以继续电离,所以混合后显碱性,正确;C项弱电解质浓度越稀电离程度越大,所以之比大于1:2,错误;D项pH相同时,弱碱氨水的浓度比氢氧化钡要大很多,中和消耗的盐酸也比氢氧化钡要多,错误。
本题考查强弱电解质的电离及盐的水解问题。A项NH4Cl溶液呈酸性,NH4+要水解,所以c(NH4+)<c(Cl-),错误;B项因为氨水是弱电解质还可以继续电离,所以混合后显碱性,正确;C项弱电解质浓度越稀电离程度越大,所以之比大于1:2,错误;D项pH相同时,弱碱氨水的浓度比氢氧化钡要大很多,中和消耗的盐酸也比氢氧化钡要多,错误。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
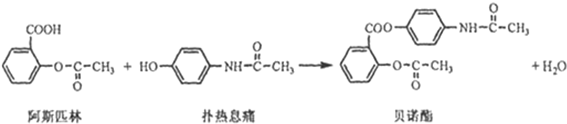
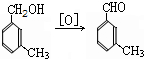
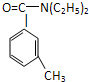 避蚊胺(又名DEET)是一种对人安全、活性高且无抗药性的新型驱蚊剂,其结构简式为:已知:RCOOH
避蚊胺(又名DEET)是一种对人安全、活性高且无抗药性的新型驱蚊剂,其结构简式为:已知:RCOOH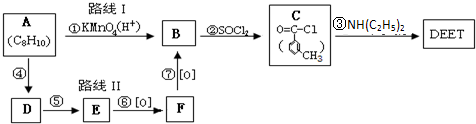
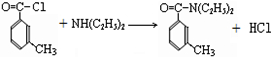
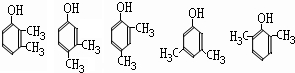 (任写2种)
(任写2种)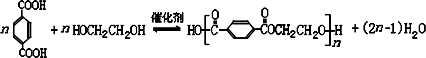
 NH3?H2O+H+
NH3?H2O+H+ (2010?崇文区二模)X、Y、Z、W均为含有10电子的微粒,其中X、Y、Z为分子,W为离子,且X与Z分子中含有的共用电子对数之比为3:4.
(2010?崇文区二模)X、Y、Z、W均为含有10电子的微粒,其中X、Y、Z为分子,W为离子,且X与Z分子中含有的共用电子对数之比为3:4.