题目内容
【题目】密闭容器中加入4 mol A、1.2 mol C和一定量的B三种气体,一定条件下发生反应,各物质的浓度随时间变化如甲图所示[已知t0~t1阶段保持恒温、恒容,且c(B)未画出]。乙图为t2时刻后改变反应条件,反应速率随时间的变化情况,已知在t2、t3、t4、t5时刻各改变一种不同的条件,其中t3时刻为使用催化剂。
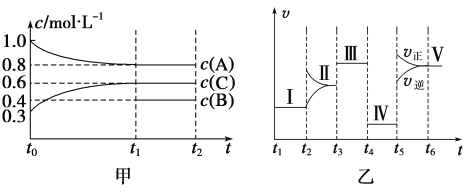
(1)若t1=15 s,则t0~t1阶段的反应速率为v(C)=___________。
(2)t4时刻改变的条件为____________,B的起始物质的量为______________。
(3)t5时刻改变的条件为_____________,该反应的逆反应为__________(填“吸热反应”或“放热反应”)。
(4)图乙中共有Ⅰ~Ⅴ五处平衡,其平衡常数最大的是_____________。
【答案】(1)0.02mol·L-1·s-1;(2)减小压强,2mol ;(3)升高温度,放热反应;(4)Ⅴ。
【解析】
试题分析:(1)根据化学反应速率的定义,v(C)=(0.6-0.3)/15mol/(L·s)= 0.02mol·L-1·s-1;
(2)化学反应速率之比等于化学计量数之比,v(A):v(C)=0.2:0.3=2:3,t4时化学平衡不移动,但反应速率降低,因此改变的条件是减小压强,降低压强,平衡不移动,说明反应前后气体系数之和相等,即B的系数为1,反应方程式为2A(g)+B(g) ![]() 3C(g),因此B的起始物质的量浓度为0.5mol·L-1,则B的物质的量为2mol;
3C(g),因此B的起始物质的量浓度为0.5mol·L-1,则B的物质的量为2mol;
(3)t5时刻正逆反应速率都增大,只能是升高温度,平衡向正反应方向移动,根据勒夏特列原理,正反应方向是吸热反应,则逆反应方向是放热反应;
(4)根据勒夏特列原理,只有t5时刻改变的条件是温度,化学平衡常数只受温度的影响,以及化学平衡常数定义,平衡常数最大的是V。

 步步高达标卷系列答案
步步高达标卷系列答案【题目】已知:2NaAlO 2 + 3H2O +CO2→2Al(OH)3↓+Na2CO3。向含2molNaOH、 1 mol Ba(OH)2、2 molNaAlO 2的混合溶液中慢慢通入CO2,则通入CO2的量和生成沉淀的量关系正确的是
选项 | A | B | C | D |
n(CO2)mol | 2 | 3 | 4 | 6 |
n(沉淀) mol | 2 | 2 | 3 | 3 |