题目内容
2. 为了探究氯气和氯水的一些化学性质,某学生用如图所示装置进行有关实验,打开A的玻璃塞,将A中浓盐酸溶液逐滴加入装有二氧化锰的B中,试回答:
为了探究氯气和氯水的一些化学性质,某学生用如图所示装置进行有关实验,打开A的玻璃塞,将A中浓盐酸溶液逐滴加入装有二氧化锰的B中,试回答:(1)怎样检验装置的气密性关闭分液漏斗,对烧瓶进行微热,看烧杯中是否有气泡产生,冷却后D中是否产生水柱.B中发生的化学反应方程式是MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)若C中为湿润的紫色石蕊试纸,在通入Cl2过程中C中可以观察到的实验现象为先变红后褪色.
(3)D的作用是防倒吸,烧杯中加入的溶液是氢氧化钠溶液,
装该溶液的目的是尾气处理.
分析 浓盐酸和二氧化锰在加热条件下反应生成氯气,发生MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,氯气与水反应生成盐酸和次氯酸,次氯酸具有漂白性,可观察到C中湿润的紫色石蕊试纸先变红后褪色,D为尾气处理装置,应加入氢氧化钠溶液,以此解答该题.
解答 解:(1)检查装置的气密性的方法是:关闭分液漏斗,对烧瓶进行微热,看烧杯中是否有气泡产生,冷却后D中是否产生水柱,浓盐酸和二氧化锰在加热条件下反应生成氯气,发生MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:关闭分液漏斗,对烧瓶进行微热,看烧杯中是否有气泡产生,冷却后D中是否产生水柱;MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)氯气与水反应生成盐酸和次氯酸,次氯酸具有漂白性,可观察到C中湿润的紫色石蕊试纸先变红后褪色,故答案为:先变红后褪色;
(3)氯气可应用氢氧化钠来进行尾气处理,球形导管可以防止倒吸,故答案为:防倒吸;氢氧化钠溶液;尾气处理.
点评 本题综合考查氯气的制备、性质探究,为高考常见题型,侧重学生的分析、实验能力的考查,注意把握物质的性质以及实验的原理,难度不大.

练习册系列答案
相关题目
10.能正确表示下列反应的离子方程式为( )
| A. | 向Fe(NO3)2稀溶液中加入稀盐酸:Fe2++2H++NO3-═Fe3++NO2↑+H2O | |
| B. | 向NaHSO4溶液中加入过量的Ba(OH)2溶液:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| C. | 向(NH4)2Mg(SO4)2溶液中加入少量的Na2O:Mg2++Na2O+H2O═Mg(OH)2↓+2Na+ | |
| D. | 向0.1mol•L-1、pH=1的NaHA溶液中加入NaOH溶液:HA-+OH-═A2-+H2O |
12.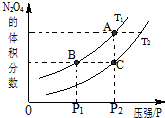 试运用所学知识,研究CO等气体的性质,请回答:
试运用所学知识,研究CO等气体的性质,请回答:
(1)生产水煤气过程中有以下反应:
①C(s)+CO2(g)?2CO(g)△H1;
②CO(g)+H2O(g)?H2(g)+CO2(g)△H2;
③C(s)+H2O(g)?CO(g)+H2(g)△H3;
反应③的平衡常数表达式为K=$\frac{c(CO)c({H}_{2})}{c({H}_{2}O)}$;上述反应中△H1、△H2、△H3之间的关系为△H1+△H2═△H3或△H2═△H3-△H1,或△H1═△H3-△H2.
(2)不同温度下反应②的平衡常数如表所示.则△H2< 0(填“<”“>”);
在500℃时,把等物质的量浓度的CO和H2O(g)充入反应容器,达到平衡时c(CO)=0.005mol/L、c(H2)=0.015mo/L,则CO的平衡转化率为75%.
(3)对于反应2NO2(g)?N2O4(g)△H<0,当温度为T1、T2时,平衡体系N2O4的体积分数随压强变化曲线如图所示.则T1<T2(填“>”或“<”);增大压强,平衡向正反应方向反应方向移动;B、C两点的平衡常数B>C(填“>”或“<”).
 试运用所学知识,研究CO等气体的性质,请回答:
试运用所学知识,研究CO等气体的性质,请回答:(1)生产水煤气过程中有以下反应:
①C(s)+CO2(g)?2CO(g)△H1;
②CO(g)+H2O(g)?H2(g)+CO2(g)△H2;
③C(s)+H2O(g)?CO(g)+H2(g)△H3;
反应③的平衡常数表达式为K=$\frac{c(CO)c({H}_{2})}{c({H}_{2}O)}$;上述反应中△H1、△H2、△H3之间的关系为△H1+△H2═△H3或△H2═△H3-△H1,或△H1═△H3-△H2.
(2)不同温度下反应②的平衡常数如表所示.则△H2< 0(填“<”“>”);
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
(3)对于反应2NO2(g)?N2O4(g)△H<0,当温度为T1、T2时,平衡体系N2O4的体积分数随压强变化曲线如图所示.则T1<T2(填“>”或“<”);增大压强,平衡向正反应方向反应方向移动;B、C两点的平衡常数B>C(填“>”或“<”).
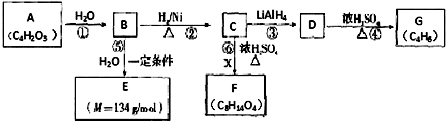
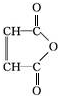 .
.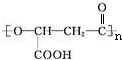 .
.
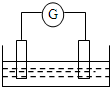 如图是常见原电池装置,电流表G发生偏转:
如图是常见原电池装置,电流表G发生偏转: E的元素符号是Cl.
E的元素符号是Cl.