题目内容
Ⅰ.无水氯化铝是某些有机化学反应中常用的催化剂,它的熔点190℃,但在180℃时已开始升华.它在常温下是一种白色固体,遇水发生剧烈的水解反应,甚至在空气中遇到微量水汽也强烈地发烟.用如图装置制取无水氯化铝:
回答以下问题:
(1)装置D中发生的化学反应方程式:
(2)仪器X与仪器Y直接相连的意图是:①收集产物;②
(3)能否去掉E装置
(4)实验时应先点燃
Ⅱ.某种胃药中止酸剂为CaCO3.为测定其中CaCO3的含量,某化学小组设计了以下方案(药片中的其他成分与HCl和NaOH溶液均不反应):
用滴定法测定,有以下几步操作:
A.配制0.100mol/L HCl溶液和0.100mol/L NaOH溶液
B.取一粒药片(0.100g),研碎后加入20.0mL蒸馏水
C.以酚酞为指示剂用0.100mol/L NaOH溶液滴定,用去NaOH溶液VmL时达到终点
D.用酸式滴定管加入25.00mL 0.100mol/L HCl溶液,充分反应
请回答有关问题:
(1)测定过程的正确操作顺序为
(2)经测定,每次消耗NaOH溶液体积的平均值为13.00mL,则该胃药中CaCO3的质量分数是

回答以下问题:
(1)装置D中发生的化学反应方程式:
2Al+3Cl2
2AlCl3
| ||
2Al+3Cl2
2AlCl3
.
| ||
(2)仪器X与仪器Y直接相连的意图是:①收集产物;②
防止堵塞
防止堵塞
.(3)能否去掉E装置
不能
不能
原因是防止E中水汽与AlCl3作用
防止E中水汽与AlCl3作用
.(4)实验时应先点燃
A
A
处的酒精灯,其作用是用氯气排尽装置中的空气以防产品不纯
用氯气排尽装置中的空气以防产品不纯
.Ⅱ.某种胃药中止酸剂为CaCO3.为测定其中CaCO3的含量,某化学小组设计了以下方案(药片中的其他成分与HCl和NaOH溶液均不反应):
用滴定法测定,有以下几步操作:
A.配制0.100mol/L HCl溶液和0.100mol/L NaOH溶液
B.取一粒药片(0.100g),研碎后加入20.0mL蒸馏水
C.以酚酞为指示剂用0.100mol/L NaOH溶液滴定,用去NaOH溶液VmL时达到终点
D.用酸式滴定管加入25.00mL 0.100mol/L HCl溶液,充分反应
请回答有关问题:
(1)测定过程的正确操作顺序为
ABDC或BADC
ABDC或BADC
(填字母).(2)经测定,每次消耗NaOH溶液体积的平均值为13.00mL,则该胃药中CaCO3的质量分数是
60%
60%
%.分析:I(1)装置D中铝粉与氯气反应生成三氯化铝;
(2)无水氯化铝在180℃时已开始升华,生成的氯化铝以气态形式进入Y装置,然后凝结为固体;
(3)无水氯化铝遇水发生剧烈的水解反应,所以要防止水蒸气进入Y装置,因此不能去掉E装置;
(4)实验装置中有空气,空气中的氧气能与铝粉反应,所以加热前先通氯气把装置中的氧气排尽;
II(1)由于A、B是并列操作,不存在先后问题;
(2)反应所用盐酸与氢氧化钠溶液的浓度相等,氢氧化钠溶液的体积为13.00 mL,则与碳酸钙反应的盐酸为25.00mL-13.00 mL=12.00 mL.根据反应:CaCO3+2HCl=CaCl2+H2O+CO2↑计算碳酸钙的质量,再根据质量分数定义计算;
(2)无水氯化铝在180℃时已开始升华,生成的氯化铝以气态形式进入Y装置,然后凝结为固体;
(3)无水氯化铝遇水发生剧烈的水解反应,所以要防止水蒸气进入Y装置,因此不能去掉E装置;
(4)实验装置中有空气,空气中的氧气能与铝粉反应,所以加热前先通氯气把装置中的氧气排尽;
II(1)由于A、B是并列操作,不存在先后问题;
(2)反应所用盐酸与氢氧化钠溶液的浓度相等,氢氧化钠溶液的体积为13.00 mL,则与碳酸钙反应的盐酸为25.00mL-13.00 mL=12.00 mL.根据反应:CaCO3+2HCl=CaCl2+H2O+CO2↑计算碳酸钙的质量,再根据质量分数定义计算;
解答:解:I(1)装置D中铝粉与氯气反应生成三氯化铝,反应方程式为:2Al+3Cl2
2AlCl3;故答案为:2Al+3Cl2
2AlCl3;
(2)无水氯化铝在180℃时已开始升华,生成的氯化铝以气态形式进入Y装置,然后凝结为固体,所以仪器X与仪器Y直接相连的目的是收集产物、防止堵塞;故答案为:防止堵塞;
(3)无水氯化铝遇水发生剧烈的水解反应,所以要防止水蒸气进入Y装置,因此不能去掉E装置,故答案为:不能;防止E中水汽与AlCl3作用;
(4)实验装置中有空气,空气中的氧气能与铝粉反应,所以加热前先通氯气把装置中的氧气排尽,所以先点燃A制取氯气;
故答案为:A;用氯气排尽装置中的空气以防产品不纯;
Ⅱ(1)由于A、B是并列操作,不存在先后问题,故可以是ABDC 或BADC.
故答案为:ABDC 或BADC.
(2)反应所用盐酸与氢氧化钠溶液的浓度相等,氢氧化钠溶液的体积为13.00 mL,则与碳酸钙反应的盐酸为25.00mL-13.00 mL=12.00 mL.根据反应:CaCO3+2HCl=CaCl2+H2O+CO2↑可知,100g:2mol=m(CaCO3):0.100 mol/L×0.012L,解得:m=0.06 g,碳酸钙的质量分数为
×100%=60%.
故答案为:60%.
| ||
| ||
(2)无水氯化铝在180℃时已开始升华,生成的氯化铝以气态形式进入Y装置,然后凝结为固体,所以仪器X与仪器Y直接相连的目的是收集产物、防止堵塞;故答案为:防止堵塞;
(3)无水氯化铝遇水发生剧烈的水解反应,所以要防止水蒸气进入Y装置,因此不能去掉E装置,故答案为:不能;防止E中水汽与AlCl3作用;
(4)实验装置中有空气,空气中的氧气能与铝粉反应,所以加热前先通氯气把装置中的氧气排尽,所以先点燃A制取氯气;
故答案为:A;用氯气排尽装置中的空气以防产品不纯;
Ⅱ(1)由于A、B是并列操作,不存在先后问题,故可以是ABDC 或BADC.
故答案为:ABDC 或BADC.
(2)反应所用盐酸与氢氧化钠溶液的浓度相等,氢氧化钠溶液的体积为13.00 mL,则与碳酸钙反应的盐酸为25.00mL-13.00 mL=12.00 mL.根据反应:CaCO3+2HCl=CaCl2+H2O+CO2↑可知,100g:2mol=m(CaCO3):0.100 mol/L×0.012L,解得:m=0.06 g,碳酸钙的质量分数为
| 0.06g |
| 0.1g |
故答案为:60%.
点评:本题考查对实验原理的理解与实验操作评价、物质含量测定、滴定原理利用,物质的制备,化学计算等,难度中等,理解实验原理是关键,是对所学知识的综合运用,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力,学习中全面把握基础知识.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目

 制备无水氯化铝的流程如下:
制备无水氯化铝的流程如下: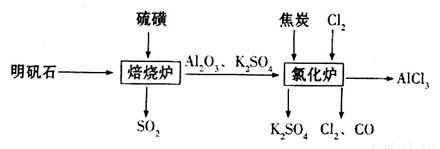
 的方法是________________________________。
的方法是________________________________。
 等大气污染物,若将二者按照一定比例通入水中可减少或消除污染。试设计简单实验检验二者是否恰好完全反应。(简要描述实验步骤、现象和结论)
等大气污染物,若将二者按照一定比例通入水中可减少或消除污染。试设计简单实验检验二者是否恰好完全反应。(简要描述实验步骤、现象和结论)

