��Ŀ����
����ܶ���С�Ľ������������������������ܶ�����������﮵�ء�
(1)д����ڿ�����ȼ�յĻ�ѧ����ʽ____����7.0 g�Ͷ������ˮ�У��ɵõ���״���µ�����___L��
(2) Li-SO2��ؾ���������ʸߡ����¡����ܺõ��ŵ㣬������ΪLiBr���ܼ���̼���ϩ�������棬Li+���������ƶ�������ܷ�ӦʽΪ2Li +2SO2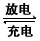 Li2S2O4�����йظõ�ص�˵����ȷ����___��
Li2S2O4�����йظõ�ص�˵����ȷ����___��
A���õ���ܷ�ӦΪ���淴Ӧ
B�����ʱ������ӦʽΪLi++e-=Li
C���ŵ�ʱLi+���ƶ�
D���õ�ص������Һ�ɻ���LiBrˮ��Һ
(3) LiH��ˮ����ǿ�ҵ�ˮ�⣬д����ˮ��Ļ�ѧ����ʽ___��������Һ��pH___ ���>������=����<����7��LiH�ĵ���ʽΪ__��
(4)Li2SO4��ˮ��Һ�п��Է�������ˮ�⣬���ж����й�ϵʽ��ȷ����___��
A.c(Li+)+c(H+)=c(OH-)+c(SO42-)
B.c(Li+)+c(H+)=c(OH-)+2c(SO42-)
C.2c(Li+) +2c(H+) =2c(OH-)+c( SO42-)
D.c(Li+) =2c(SO42-)
(1)д����ڿ�����ȼ�յĻ�ѧ����ʽ____����7.0 g�Ͷ������ˮ�У��ɵõ���״���µ�����___L��
(2) Li-SO2��ؾ���������ʸߡ����¡����ܺõ��ŵ㣬������ΪLiBr���ܼ���̼���ϩ�������棬Li+���������ƶ�������ܷ�ӦʽΪ2Li +2SO2
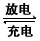 Li2S2O4�����йظõ�ص�˵����ȷ����___��
Li2S2O4�����йظõ�ص�˵����ȷ����___�� A���õ���ܷ�ӦΪ���淴Ӧ
B�����ʱ������ӦʽΪLi++e-=Li
C���ŵ�ʱLi+���ƶ�
D���õ�ص������Һ�ɻ���LiBrˮ��Һ
(3) LiH��ˮ����ǿ�ҵ�ˮ�⣬д����ˮ��Ļ�ѧ����ʽ___��������Һ��pH___ ���>������=����<����7��LiH�ĵ���ʽΪ__��
(4)Li2SO4��ˮ��Һ�п��Է�������ˮ�⣬���ж����й�ϵʽ��ȷ����___��
A.c(Li+)+c(H+)=c(OH-)+c(SO42-)
B.c(Li+)+c(H+)=c(OH-)+2c(SO42-)
C.2c(Li+) +2c(H+) =2c(OH-)+c( SO42-)
D.c(Li+) =2c(SO42-)
(1)4Li+O2 2Li2O��11.2
2Li2O��11.2
(2)B
(3)LiH+H2O=LiOH+H2����>��
(4)B
 2Li2O��11.2
2Li2O��11.2(2)B
(3)LiH+H2O=LiOH+H2����>��

(4)B

��ϰ��ϵ�д�
�����Ŀ
��������ܶ���С�Ľ������������Ľ�������ͷų�����ĵ��ӣ��ʳ������Ƹ�������أ���֪﮵Ľ����Խ����ƺ�þ֮�䣬��������ұ��������﮵ķ����ǣ�������
| A����ⷨ | B���Ȼ�ԭ�� | C���ȷֽⷨ | D��Ǧ�ȷ� |
�ҹ����������̲��ŷḻ�����Դ������﮵���;��һ����Ҫ��ѧ���⣮���й���﮵������У�������ǣ�������
| A������ܶ���С�Ľ��� | B�����O2��Ӧ�����ƾ��ң�����Li2O | C��LiOH�ļ��Ա�NaOHǿ | D�������Ȼ��ʱ��������Ϻ�ɫ |