题目内容
12.某有机物A是无色液体,取一定量的A在1.01×105Pa和120℃下使其全部气化,测得其蒸气的体积为57.9mL,在231.6mL氧气中点燃,恰好完全燃烧,生成CO2和水蒸气体积相等.当恢复到原状态时,测得混合气体的密度比原混合气体减少$\frac{1}{6}$,求该有机物A的分式式,并写出其可能有的结构简式.分析 有机物A完全燃烧生成CO2和水蒸气体积相等,说明A分子中C、H原子数目之比为1:2,当恢复到原状态时,水为气体,混合气体总质量不变,测得混合气体的密度比原混合气体减少$\frac{1}{6}$,则反应后混合气体的体积为原来的$\frac{6}{5}$,设A的分子式为CxH2xOy,发生反应:CxH2xOy+$\frac{3x-y}{2}$O2$\stackrel{点燃}{→}$xCO2+xH2O(g),根据消耗的氧气及反应前后气体体积关系列方程计算确定分子式,进而书写可能的结构简式.
解答 解:有机物A完全燃烧生成CO2和水蒸气体积相等,说明A分子中C、H原子数目之比为1:2,设A的分子式为CxH2xOy,则:
CxH2xOy+$\frac{3x-y}{2}$O2$\stackrel{点燃}{→}$xCO2+xH2O(g),
1 $\frac{3x-y}{2}$
57.9mL 231.6mL
故1:$\frac{3x-y}{2}$=57.9mL:231.6mL,故$\frac{3x-y}{2}$=4,则3x-y=8,
当恢复到原状态时,水为气体,混合气体总质量不变,测得混合气体的密度比原混合气体减少$\frac{1}{6}$,则反应后混合气体的体积为原来的$\frac{6}{5}$,则:x+x=(1+4)×$\frac{6}{5}$,故x=3,则y=1,
故有机物A的分子式为C3H6O,
可能的结构简式有:CH3CH2CHO、 等,
等,
答:有机物A的分子式为C3H6O,可能的结构简式有:CH3CH2CHO、 等.
等.
点评 本题考查有机物分子计算,判断分子中C、H原子数目关系,假设有机物的组成通式,再利用燃烧方程式进行计算,侧重考查学生分析计算能力,难度中等.

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案| A. | 碳酸钠溶液中通入少量SO2:2CO32-+SO2+H2O=2HCO3-+SO32- | |
| B. | Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═Fe2++I2 | |
| C. | 少量氯气通入溴化亚铁溶液中3Cl2+2Fe2++4Br-═6Cl-+2Fe3++2Br2 | |
| D. | NaHCO3溶液水解:HCO3-+H2O=H2CO3+OH- |
| A. | 石蕊试液 | B. | 品红溶液 | C. | 澄清石灰水 | D. | 氯化钡溶液 |
| A. | 13Al | B. | 13Al | C. | 13C | D. | 13C |
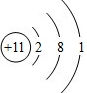 ;A、B两元素形成化合物的名称是氯化钠,用电子式表示该化合物的形成过程
;A、B两元素形成化合物的名称是氯化钠,用电子式表示该化合物的形成过程 .
.
 ;
; R、X、Y、Z是位于前四周期的元素,基态R原子核外电子占据3个能级,且每个能级上电子数相等,Y、X能组成两种阳、阴离子个数比为1:1、2:1型化合物.ZX2是常见的催化剂、氧化剂和电极材料,R、X、Y组成一种常见化合物,其水溶液常用于餐具的洗涤剂.R、X、Y原子的质子数之和等于Z的质子数.
R、X、Y、Z是位于前四周期的元素,基态R原子核外电子占据3个能级,且每个能级上电子数相等,Y、X能组成两种阳、阴离子个数比为1:1、2:1型化合物.ZX2是常见的催化剂、氧化剂和电极材料,R、X、Y组成一种常见化合物,其水溶液常用于餐具的洗涤剂.R、X、Y原子的质子数之和等于Z的质子数.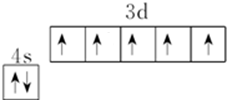 ;上述四种元素中,第一电离能最小的元素的基态原子核外有11种不同的电子运动状态.
;上述四种元素中,第一电离能最小的元素的基态原子核外有11种不同的电子运动状态.