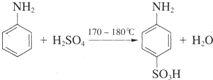
题目内容
(2010?江苏二模)某校化学兴趣小组设计了图示实验装置Ⅰ(图中省略了夹持仪器)来测定某铁碳合金中铁的质量分数.试填空.

(1)往铁碳合金中加入浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:
①常温下碳与浓硫酸不反应;②
(2)写出加热时A中碳与浓硫酸发生反应的化学方程式
(3)B中的现象是:
(4)甲同学认为利用装置Ⅰ测得铁的质量分数偏大,请你写出可能的原因:
(5)乙同学认为用装置Ⅰ操作较繁杂,于是他设计了图示装置Ⅱ,若再使用其它仪器可测得如下数据:
①反应前后干燥管质量差a g ②反应前后装置和药品的总质量之差b g
③用排水法得H2的体积V L ④反应后过滤、洗涤、干燥得残渣质量c g
试选用上述数据,以简便和精确地测算铁的质量分数,其代数式为
.

(1)往铁碳合金中加入浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:
①常温下碳与浓硫酸不反应;②
常温下Fe遇浓硫酸发生钝化
常温下Fe遇浓硫酸发生钝化
.(2)写出加热时A中碳与浓硫酸发生反应的化学方程式
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O
| ||
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O
.
| ||
(3)B中的现象是:
品红溶液褪色
品红溶液褪色
;C的作用是:除尽反应产物中的SO2气体
除尽反应产物中的SO2气体
.(4)甲同学认为利用装置Ⅰ测得铁的质量分数偏大,请你写出可能的原因:
装置内的CO2难以赶尽,导致E质量增重偏小
装置内的CO2难以赶尽,导致E质量增重偏小
.(5)乙同学认为用装置Ⅰ操作较繁杂,于是他设计了图示装置Ⅱ,若再使用其它仪器可测得如下数据:
①反应前后干燥管质量差a g ②反应前后装置和药品的总质量之差b g
③用排水法得H2的体积V L ④反应后过滤、洗涤、干燥得残渣质量c g
试选用上述数据,以简便和精确地测算铁的质量分数,其代数式为
| m-c |
| m |
| m-c |
| m |
分析:(1)依据铁在常温下在浓硫酸中钝化,碳和浓硫酸需要加热反应分析;
(2)碳和浓硫酸加热反应生成二氧化碳、二氧化硫和水,配平书写化学方程式;
(3)气体中含有二氧化硫,通过品红溶液会褪色,通过高锰酸钾溶液可以除去二氧化硫,避免干扰二氧化碳的测定;
(4)装置中的二氧化碳气体不能全部赶出,E则质量测定偏小,测定的铁的质量偏大;
(5)依据装置分析,①反应前后干燥管质量差a g 为水的质量;
②反应前后装置和药品的总质量之差b g为生成的氢气质量;
③用排水法得H2的体积V L,不知温度和压强;
④反应后过滤、洗涤、干燥得残渣质量c g为碳单质的质量.
(2)碳和浓硫酸加热反应生成二氧化碳、二氧化硫和水,配平书写化学方程式;
(3)气体中含有二氧化硫,通过品红溶液会褪色,通过高锰酸钾溶液可以除去二氧化硫,避免干扰二氧化碳的测定;
(4)装置中的二氧化碳气体不能全部赶出,E则质量测定偏小,测定的铁的质量偏大;
(5)依据装置分析,①反应前后干燥管质量差a g 为水的质量;
②反应前后装置和药品的总质量之差b g为生成的氢气质量;
③用排水法得H2的体积V L,不知温度和压强;
④反应后过滤、洗涤、干燥得残渣质量c g为碳单质的质量.
解答:解:(1)依据铁在常温下在浓硫酸中钝化,碳和浓硫酸需要加热反应分析可知,往铁碳合金中加入浓硫酸,未点燃酒精灯前,A、B均无明显现象,
故答案为:常温下Fe遇浓硫酸发生钝化;
(2)碳和浓硫酸加热反应生成二氧化碳、二氧化硫和水,则化学方程式为C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O;
(3)气体中含有二氧化硫,通过品红溶液会褪色,通过高锰酸钾溶液可以除去二氧化硫,避免干扰二氧化碳的测定,
故答案为:品红溶液褪色;除尽反应产物中的SO2气体;
(4)装置中的二氧化碳气体不能全部赶出,E装置测定的质量偏小,导致测定的铁的质量偏大;
故答案为:装置内的CO2难以赶尽,导致E质量增重偏小;
(5)依据装置分析,①反应前后干燥管质量差a g 为水的质量;
②反应前后装置和药品的总质量之差b g为生成的氢气质量;
③用排水法得H2的体积V L,不知温度和压强;
④反应后过滤、洗涤、干燥得残渣质量c g为碳单质的质量;
分析上述数据可知,简便和精确地测算铁的质量分数利用碳单质的质量计算最为简捷,铁的质量分数=
,
故答案为:
.
故答案为:常温下Fe遇浓硫酸发生钝化;
(2)碳和浓硫酸加热反应生成二氧化碳、二氧化硫和水,则化学方程式为C+2H2SO4(浓)
| ||
故答案为:C+2H2SO4(浓)
| ||
(3)气体中含有二氧化硫,通过品红溶液会褪色,通过高锰酸钾溶液可以除去二氧化硫,避免干扰二氧化碳的测定,
故答案为:品红溶液褪色;除尽反应产物中的SO2气体;
(4)装置中的二氧化碳气体不能全部赶出,E装置测定的质量偏小,导致测定的铁的质量偏大;
故答案为:装置内的CO2难以赶尽,导致E质量增重偏小;
(5)依据装置分析,①反应前后干燥管质量差a g 为水的质量;
②反应前后装置和药品的总质量之差b g为生成的氢气质量;
③用排水法得H2的体积V L,不知温度和压强;
④反应后过滤、洗涤、干燥得残渣质量c g为碳单质的质量;
分析上述数据可知,简便和精确地测算铁的质量分数利用碳单质的质量计算最为简捷,铁的质量分数=
| m-c |
| m |
故答案为:
| m-c |
| m |
点评:本题考查了物质性质的实验探究和测定方法分析判断,掌握物质性质和实验过程分析是解题的关键,题目难度中等.

练习册系列答案
相关题目