题目内容
18.下列电子式中正确的是( )| A. |  | B. |  | C. |  | D. |  |
分析 A、氮气分子中存在氮氮三键,氮原子最外层为8电子;
B、NH3属于共价化合物,不存在离子键,分子中存在3对共用电子对,氮原子最外层为8个电子;
C、氯化钠是离子化合物,阴离子的电子式要标出最外层电子;
D、水为共价化合物,氧原子最外层8个电子,分子中存在两个氧氢键.
解答 解:A、氮气分子中存在氮氮三键,氮原子最外层为8电子,故N2的电子式为 ,故A错误;
,故A错误;
B、NH3属于共价化合物,不存在离子键,分子中存在3对共用电子对,氮原子最外层为8个电子,氨气的电子式为 ,故B错误;
,故B错误;
C、氯化钠是离子化合物,是钠离子和氯离子通过静电作用形成的,其电子式为 ,故C正确;
,故C正确;
D、水中存在两个氧氢键,氧原子最外层达到8电子稳定结构,水的电子式为 ,故D错误.
,故D错误.
故选C.
点评 本题考查了电子式的书写方法,明确水分子含有化学键类型、氮气分子的结构特点是解题关键,题目难度不大.

练习册系列答案
相关题目
13.已知CHCl=CHCl有两种同分异构体,则化学式为C3H5Cl的链状的同分异构体共有( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
3.下列说法不正确的是( )
| A. | 若反应物总能量大于生成物总能量则反应为放热反应 | |
| B. | 电池工作时将化学能转变成电能 | |
| C. | 绿色植物光合作用过程中太阳能转变成化学能 | |
| D. | 生物质能只能通过含有生物质能的物质的直接燃烧转化成热能从而被利用 |
7.砹(At)是原子序数最大的卤族元素,推测砹及其化合物最不可能具有的性质是( )
| A. | 砹是有色固体 | B. | 砹易溶于有机溶剂 | ||
| C. | H2很难与砹化合 | D. | HAt比HCl稳定 |
 (或
(或 ).
). ,⑤的电子式是
,⑤的电子式是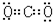 .
.
 (1)为了做到合理营养,我国营养学家将食物分为A、B、C、D、E五类,请回答下列问题:①营养学家将这五类形象地设计成图示的“平衡膳食宝塔”,并提倡居民每天均衡地吃这五类食物.为保证身体健康,建议在每日摄入的总能量中,早、中、晚餐的能量比例是3:4:3.
(1)为了做到合理营养,我国营养学家将食物分为A、B、C、D、E五类,请回答下列问题:①营养学家将这五类形象地设计成图示的“平衡膳食宝塔”,并提倡居民每天均衡地吃这五类食物.为保证身体健康,建议在每日摄入的总能量中,早、中、晚餐的能量比例是3:4:3.