题目内容
金属镍有广泛的用途,粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述中正确的是(已知氧化性:Fe2+<Ni2+<Cu2+)( )
| A、电解后,Cu和Pt沉降在电解槽底部的阳极泥中 |
| B、电解过程中,电解质溶液的浓度一定不变 |
| C、电解后,溶液中存在的金属阳离子只有Fe2+ 和Zn2+ |
| D、阳极发生还原反应,其电极反应式为:Ni2++2e-=Ni |
考点:电解原理
专题:电化学专题
分析:A、粗镍中含有少量Fe、Zn、Cu、Pt等杂质做阳极,铜和鉑不失电子沉降电解池底部形成阳极泥;
B、阳极失电子的有Fe、Zn、Cu;阴极析出的是铜;
C、精炼过程中,电解质溶液中一定含有Ni2+;
D、阳极失去电子发生氧化反应.
B、阳极失电子的有Fe、Zn、Cu;阴极析出的是铜;
C、精炼过程中,电解质溶液中一定含有Ni2+;
D、阳极失去电子发生氧化反应.
解答:
解:A、粗镍中含有少量Fe、Zn、Cu、Pt等杂质做阳极,铜和鉑不失电子沉降电解池底部形成阳极泥,电解后,电解槽底部的阳极泥中只有Cu和Pt,故A正确;
B、电解过程中阳极失电子的有Fe、Zn、Cu;阴极析出的是铜;依据电子守恒,阳极质量的减少与阴极质量的增加不相等,电解过程中,电解质溶液的浓度降低,故B错误;
C、电解后,溶液中存在的金属阳离子有Fe2+、Zn2+、Ni2+,故C错误;
D、阳极发生氧化反应,其电极反应式:Ni-2e-=Ni2+、Fe-2e-=Fe2+、Zn-2e-=Zn2+,故D错误;
故选A.
B、电解过程中阳极失电子的有Fe、Zn、Cu;阴极析出的是铜;依据电子守恒,阳极质量的减少与阴极质量的增加不相等,电解过程中,电解质溶液的浓度降低,故B错误;
C、电解后,溶液中存在的金属阳离子有Fe2+、Zn2+、Ni2+,故C错误;
D、阳极发生氧化反应,其电极反应式:Ni-2e-=Ni2+、Fe-2e-=Fe2+、Zn-2e-=Zn2+,故D错误;
故选A.
点评:本题考查了电极原理的应用,主要考查电解精炼镍的原理分析判断,题目难度中等.

练习册系列答案
相关题目
下列有关说法,不正确的是( )
①将盛有二氧化氮气体的试管倒立在水中,溶液会充满试管
②铁分别于氯气和稀盐酸反应所得氯化物相同
③为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化
④常温下,pH=12的溶液一定能大量存在:K+、Cl-、SO32-、S2
⑤将Na2O2加入H2O中Na2O2+H2O=2Na++2OH-+O2↑
①将盛有二氧化氮气体的试管倒立在水中,溶液会充满试管
②铁分别于氯气和稀盐酸反应所得氯化物相同
③为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化
④常温下,pH=12的溶液一定能大量存在:K+、Cl-、SO32-、S2
⑤将Na2O2加入H2O中Na2O2+H2O=2Na++2OH-+O2↑
| A、①②③⑤ | B、②③④ |
| C、①③④ | D、①②④⑤ |
室温时,将浓度和体积分别为c1、v1的NaOH溶液和c2、v2的CH3COOH溶液相混合,下列关于该混合溶液的叙述正确的是( )
| A、若pH>7时,则一定是c1v1=c2v2 |
| B、在任何情况下都是c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
| C、当pH=7时,可能有c1/c2>v2/v1 |
| D、若V1=V2,c1=c2,则C(CH3COO-)=C(Na+) |
设在密闭容器中进行下列反应C(固)+CO2(气)?2CO(气)反应速率为 v1;CO(气)+NO2(气)?CO2(气)+NO(气)反应速率为 v2对于上述反应,恒温时增大压强,v1和v2的变化情况为( )
| A、v1、v2都增大 |
| B、v1增大,v2不变 |
| C、v1增大,v2减小 |
| D、无法确定 |
将0.1mol下列物质置于1L水中,充分搅拌后,溶液中阴离子数目最多的是( )
| A、KCl |
| B、Mg(OH)2 |
| C、Na2CO3 |
| D、NaHSO4 |
下列说法正确的是( )
| A、金刚石与60C互为同位素 |
| B、碳酸氢钠的热稳定性比碳酸钠的强 |
| C、能够使澄清的石灰水变浑浊的气体一定是CO2 |
| D、碳酸钠溶液和碳酸氢钠溶液都能与澄清的石灰水反应生成沉淀 |
下列说法正确的是( )
A、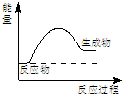 如图所示的是一个放热反应 |
| B、加入催化剂v(正)增大、v(逆)减小 |
| C、吸热反应只能在加热的条件下才能进行 |
| D、只有活化分子才能发生有效碰撞 |
 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: