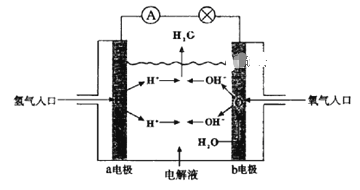
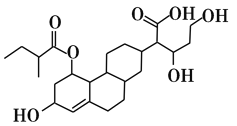
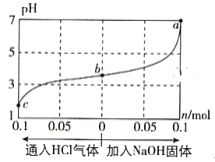
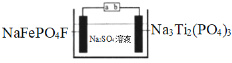
��Ŀ����
����Ŀ��[��ѧ��ѡ��3�����ʽṹ������]
ǰ������ԭ���������������Ԫ��A��B��C��D�У�A��B�ļ۵��Ӳ���δ�ɶԵ��Ӿ�ֻ��1����ƽ��A-��B+�ĵ������Ϊ8����Bλ��ͬһ���ڵ�C��D�����Ǽ۵��Ӳ��е�δ�ɶԵ������ֱ�Ϊ4��2����ԭ���������Ϊ2��
�ش��������⣺
��1��D2+�ļ۲�����Ų�ͼΪ_______��
��2������Ԫ���е�һ������С����________���縺��������________������Ԫ�ط��ţ�
��3��A��B��D����Ԫ����ɵ�һ��������ľ�����ͼ��ʾ��
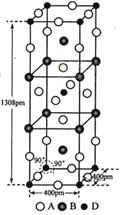
���û�����Ļ�ѧʽΪ_________________��D����λ��Ϊ___________��
����ʽ����þ�����ܶ�_______g��cm-3��
��4��A-��B+��C3+����������ɵĻ�����B3CA6�����л�ѧ����������_____________���û������д���һ���������ӣ������ӵĻ�ѧʽΪ_______________����λ����____________��
���𰸡�![]() K F K2NiF4 6
K F K2NiF4 6 ![]() =3.4 ���Ӽ�����λ�� [FeF6]3- F-
=3.4 ���Ӽ�����λ�� [FeF6]3- F-
��������
��1�����⿼������Ų�ͼ����д��A��B�ļ۵��Ӳ���δ�ɶԵ��Ӿ�ֻ��1�����ӣ�A��Bλ�ڵ�IA�壬���IIIA��Ԫ�ػ�VIIA��Ԫ�أ�A����B���ĵ��������Ϊ8���Ƴ�AΪF��BΪK����Bλ��ͬһ���ڵ�C��D�����Ǽ۵��Ӳ��е�δ�ɶԵ������ֱ�Ϊ4��2����ԭ���������Ϊ2����CΪFe��DΪNi��D2��ΪNi2������۲�����Ų�ͼΪ![]() ��
��
��2����һ������ԽС��˵��Խ����ʧȥ���ӣ���������ǿ����һ��������С����K���縺�����˵���ǽ�������ǿ����F�ĵ縺����ǿ��
��3���ٸ��ݾ����Ľṹ��Fλ�����ϡ������ڲ��������ϣ����F�ĸ���Ϊ16��1/4��4��1/2��2=8��Kλ�����Ϻ��ڲ�������Ϊ8��1/4��2=4��Niλ�ڶ�����ڲ�������Ϊ8��1/8��1=2����˻�ѧʽΪK2NiF4��Ni����λ��Ϊ6��
�ھ���������Ϊ1��(39��4��59��2��19��8)/NA g�����������Ϊ400��400��1308��10-30cm3����˾������ܶ�Ϊ![]() =3.4g/cm3��
=3.4g/cm3��
��4����ɵĻ�ѧʽΪK3FeF6���˻�������������K����FeF63��֮�������Ӽ���Fe��F֮��Ϊ��λ������������[FeF6]3��������ΪF-��

 ����ͼ���������������ϵ�д�
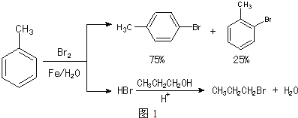
����ͼ���������������ϵ�д�����Ŀ��ʵ����ģ��ϳ�![]() ��CH3CH2CH2Br�ķ�����ͼ1��
��CH3CH2CH2Br�ķ�����ͼ1��
��֪���ױ���Һ����������ˮ����ʱҲ�ܷ�Ӧ(��ͼ2)��

ʵ����ģ��ϳɶ���ױ���1-���������̺�������������
���� | �ױ� | 1-���� | 1-����� | ����ױ� | ����ױ� |
�е�(��) | 110.8 | 97.2 | 71 | 184.3 | 181.7 |
��1��ʵ���Ҵ��Һ����Լ�ƿ���ܱգ�ͬʱƿ��Ҫ����____���Լ�����Ļӷ�.д���ױ���Һ�巴Ӧ���ɶ���ױ��Ļ�ѧ����ʽ___��
��2����Ӧװ����ͼ3��ʾ��
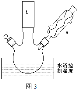
��ͼ�в�������a��������____������b��Ϊij������������������___��
��������ƿ�п�ʼ�����˼ױ������ۺ�ˮ�����������ˮ�������ǣ����ڿ����¶Ⱥ�____�����Ƚ�������м���Ũ���ᣬ���1-������ȡ����Ӧ��Ũ�����������____��
��3������I��������___���������������___��
����Ŀ�����±���ʾΪԪ�����ڱ���һ���֣�����Ԫ�آ١����ڱ��е�λ�ã���ش��������⣺
�� ���� | IA | 0 | ||||||
1 | �� | IIA | IIIA | IVA | VA | VIA | VIIA | |
2 | �� | �� | ||||||
3 | �� | �� | �� | �� | ||||
��1���ۢܢߵ�ԭ�Ӱ뾶�ɴ�С��˳��Ϊ____����Ԫ�ط��ű�ʾ����
��2���͢ߵ���ۺ����������ǿ��Ϊ____������Ļ�ѧʽ��ʾ����
��3���ڢ�����Ԫ�ذ�ԭ�Ӹ���֮��Ϊ1��1��ɵĻ�����ĵ���ʽ____��
��4���٢�����Ԫ�ذ�ԭ�Ӹ���֮��Ϊ1��1��ɵij���Һ̬�������������Һ���ܽ�Fe2+������д���÷�Ӧ�����ӷ���ʽ___��
��5�����Тݵĵ��ʺܵ͢����������ˮ���ﷴӦ�Ļ�ѧ����ʽΪ____��