题目内容
【题目】常温下,![]() 的
的![]() 溶液中,
溶液中,![]() 、
、![]() 、
、![]() 三者所占物质的量分数
三者所占物质的量分数![]() 分布系数
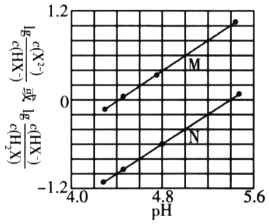
分布系数![]() 随pH变化的关系如图所示。下列表述不正确的是
随pH变化的关系如图所示。下列表述不正确的是
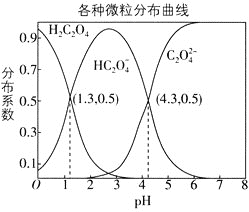
A.![]() 的平衡常数
的平衡常数![]()
B.将等物质的量的![]() 、
、![]() 溶于水中,所得溶液pH恰好为
溶于水中,所得溶液pH恰好为![]()
C.常温下HF的电离常数![]() ,将少量
,将少量![]() 溶液加入到足量NaF溶液中,发生的反应为:H2C2O4+F-=HF+HC2O4-
溶液加入到足量NaF溶液中,发生的反应为:H2C2O4+F-=HF+HC2O4-
D.在![]() 溶液中,各离子浓度大小关系为
溶液中,各离子浓度大小关系为![]()
【答案】B
【解析】
A. 由各微粒分布曲线图知,![]() 时,
时,![]() 与
与![]() 的浓度相同,且二者的分布系数均为
的浓度相同,且二者的分布系数均为![]() ,可得
,可得![]() ,故A正确;
,故A正确;
B.![]() 的水解反应为
的水解反应为![]() ,由图中第二个交点可求出
,由图中第二个交点可求出![]() 的电离平衡常数为
的电离平衡常数为![]() ,
,![]() 的水解平衡常数为
的水解平衡常数为 ,故
,故![]() 的水解程度小于
的水解程度小于![]() 的电离程度,等物质的量的
的电离程度,等物质的量的![]() 、
、![]() 溶于水中,
溶于水中,![]() ,
,![]() ,故B错误;
,故B错误;
C. 类似于A项的分析,可以推算出反应![]() 的平衡常数
的平衡常数![]() ,根据强酸制弱酸原理可得
,根据强酸制弱酸原理可得![]() ,故C正确;
,故C正确;
D. ![]() 的水解平衡
的水解平衡![]()
的平衡常数
![]() ,说明
,说明![]() 的电离程度大于其水解程度,故
的电离程度大于其水解程度,故![]() 溶液中:
溶液中:![]() ,故D正确。
,故D正确。
故选B。

【题目】某些化学问题可用相似的示意图来表示。下列说法不正确的是![]()
选项 | 横坐标 | 纵坐标 | 研究对象 |
A | 反应时间 | 溶液温度 | 足量镁条放在 |
B | 反应温度 | 反应速率 | 酶催化反应 |
C | 盐酸体积 | 沉淀质量 |
|
D | 反应过程 | 能量 |
|
A.AB.BC.CD.D
【题目】在常温、常压和光照条件下,N2在催化剂表面与H2O发生反应:2N2(g)+6H2O(l) =4NH3(g)+3O2(g)。在2 L的密闭容器中,起始反应物用量相同,催化剂的使用情况也相同,控制不同温度分别进行4组实验,3 h后测定NH3的生成量,所得数据如下表:
实验级别 | 实验1 | 实验2 | 实验3 | 实验4 |
温度/K | 303 | 313 | 323 | 353 |
NH3生成量/106mol | 4.8 | 5.9 | 6.0 | 2.0 |
下列说法不正确的是
A. 温度为303 K时,在3 h内用氮气表示的平均反应速率为4×107mol·L1·h1
B. 实验1和实验3中,3 h内N2的转化率之比为4:5
C. 分析四组实验数据可得出,温度升高可加快反应速率,也可能减慢反应速率
D. 353 K时,可能是催化剂催化活性下降或部分水脱离催化剂表面,致使化学反应速率减慢