题目内容
下列叙述中正确的是( )
分析:A.根据化合价的变化判断;
B.HClO为弱电解质,加入少量SO2,生成HClO;
C.从化合价的变化的角度分析;
D.从化合价的变化的角度结合质量守恒分析.
B.HClO为弱电解质,加入少量SO2,生成HClO;
C.从化合价的变化的角度分析;
D.从化合价的变化的角度结合质量守恒分析.
解答:解:A.2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O,Cu(IO3)2中Cu的化合价由+2→+1,I的化合价由+5→0,1mol氧化剂得到11mole-,故A正确;
B.向NaClO溶液中通入少量SO2,发生ClO-+SO2+H2O=Cl-+SO42-+2H+,H++ClO-=HClO,加入少量SO2,生成HClO,故B错误;
C.CuSO4→Cu2S,FeS2→Cu2S,Cu和S的化合价都降低,所以Cu2S还原产物,故C错误;
D.应为FeSO4和HNO3的反应,生成物有N2O、Fe2(SO4)3、Fe(NO3)3和H2O,反应中N元素的化合价降低生成,则N2O为还原产物,故D正确.
故选AD.
B.向NaClO溶液中通入少量SO2,发生ClO-+SO2+H2O=Cl-+SO42-+2H+,H++ClO-=HClO,加入少量SO2,生成HClO,故B错误;
C.CuSO4→Cu2S,FeS2→Cu2S,Cu和S的化合价都降低,所以Cu2S还原产物,故C错误;
D.应为FeSO4和HNO3的反应,生成物有N2O、Fe2(SO4)3、Fe(NO3)3和H2O,反应中N元素的化合价降低生成,则N2O为还原产物,故D正确.
故选AD.
点评:本题考查氧化还原反应,题目难度较大,注意从化合价变化的角度分析氧化还原反应,本题易错点为B和C,注意离子反应的产物.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
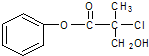 有机物A是农药生产中的一种中间体,结构简式如图所示.下列叙述中正确的是( )
有机物A是农药生产中的一种中间体,结构简式如图所示.下列叙述中正确的是( )| A、有机物A可以在一定条件下与HBr发生反应 | B、1mol A最多能与4mol H2发生加成反应 | C、有机物A与浓硫酸混合加热,可以发生消去反应 | D、1mol A与足量的NaOH溶液反应,最多可以消耗3mol NaOH |


