题目内容
在密闭容器中,N2、H2起始的物质的量分别为10mol、30mol,达到平衡时N2的转化率为25%,若反应从NH3的分解开始,在相同条件下欲使平衡时各成分百分含量相同,则应加入氨的物质的量为__________,氨的转化率为__________。
【答案】
20mol;75%
【解析】
试题分析:10mol氮气和30mol氢气就相当于是20mol氨气,所以若反应从NH3的分解开始,在相同条件下欲使平衡时各成分百分含量相同,则根据平衡的建立和途径无关可判断,需要氨气的物质的量就是20mol;
达到平衡时N2的转化率为25%,则根据反应式N2 + 3H2  2NH3可知生成的氨气是2.5mol×2=5mol,所以从20mol氨气开始建立平衡,则氨气的转化率就是
2NH3可知生成的氨气是2.5mol×2=5mol,所以从20mol氨气开始建立平衡,则氨气的转化率就是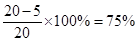 。
。
考点:考查可逆反应的有关计算和等效平衡的有关判断
点评:所谓等效平衡是指外界条件相同时,同一可逆反应只要起始浓度相当,无论经过何种途径,都可以达到相同的平衡状态。等效平衡的判断及处理一般步骤是:进行等效转化——边倒法,即按照反应方程式的计量数之比转化到同一边的量,与题干所给起始投料情况比较即可。本题有利于培养学生的逻辑思维能力,有利于调动学生的学习积极性。

练习册系列答案
相关题目
下列各项中的两个量,其比值一定为2:1的是( )
| A、相同温度下,0.2mol/LCH3COOH溶液与0.1mol/L CH3COOH溶液中c(H+) | B、在反应2FeCl3+Fe?3FeCl2中还原产物与氧化产物的质量 | C、在密闭容器中,N2+3H2?2NH3已达平衡时c(NH3)与c(N2) | D、液面均在“O”刻度时,50mL碱式滴定管和25mL碱式滴定管所盛溶液的体积 |
 2NH3已达平衡时c(NH3)与c(N2)
2NH3已达平衡时c(NH3)与c(N2)