题目内容
下列叙述正确的是( )
| A、6.4gCu与足量硫完全反应,转移的电子数为0.1NA |
| B、能使湿润的KI淀粉试纸变蓝的气体一定是Cl2 |
| C、分离Na2CO3溶液和CH3COOC2H5常用蒸馏法 |
| D、将H2S通入FeCl3溶液中会产生淡黄色沉淀,继续通入则会产生黑色沉淀 |
考点:氧化还原反应的电子转移数目计算,氯气的化学性质,硫化氢,物质的分离、提纯的基本方法选择与应用
专题:
分析:A.反应方程式为2Cu+S
Cu2S,n(Cu)=
=0.1mol,该反应中Cu元素化合价由0价变为+1价,据此计算转移电子数;
B.能使湿润的淀粉碘化钾试纸变蓝色的气体不一定是氯气;
C.分离互不相溶的液体采用分液的方法分离;
D.二者发生氧化还原反应生成亚铁离子和S单质.
| ||
| 6.4g |
| 64g/mol |
B.能使湿润的淀粉碘化钾试纸变蓝色的气体不一定是氯气;
C.分离互不相溶的液体采用分液的方法分离;
D.二者发生氧化还原反应生成亚铁离子和S单质.
解答:
解:A.反应方程式为2Cu+S
Cu2S,n(Cu)=
=0.1mol,该反应中Cu元素化合价由0价变为+1价,则6.4gCu与足量硫完全反应,转移的电子数为0.1NA,故A正确;
B.能使湿润的淀粉碘化钾试纸变蓝色的气体不一定是氯气,如氧气,故B错误;
C.碳酸钠溶液和乙酸乙酯为互不相溶的液体,所以应该采用分液方法分离,故C错误;
D.二者发生氧化还原反应生成亚铁离子和S单质,HCl酸性大于H2S,所以H2S和亚铁离子不反应,故D错误;
故选A.
| ||
| 6.4g |
| 64g/mol |
B.能使湿润的淀粉碘化钾试纸变蓝色的气体不一定是氯气,如氧气,故B错误;
C.碳酸钠溶液和乙酸乙酯为互不相溶的液体,所以应该采用分液方法分离,故C错误;
D.二者发生氧化还原反应生成亚铁离子和S单质,HCl酸性大于H2S,所以H2S和亚铁离子不反应,故D错误;
故选A.
点评:本题考查物质分离和提纯、氧化还原反应等知识点,明确物质的性质是解本题关键,注意A中Cu元素化合价变化,注意D中硫化氢的还原性,这些都是易错点,知道物质分离、提纯的方法有分液、过滤、蒸馏等,题目难度不大.

练习册系列答案
相关题目
在某100mL混合酸中,硝酸物质的量浓度为0.4mol/L,硫酸物质的量浓度为0.2mol/L,向其中加入3.2g铜粉,微热,待其充分反应后,溶液中铜离子的物质的量浓度约为( )
| A、0.15mol/L |
| B、0.3mol/L |
| C、0.5mol/L |
| D、无法计算 |
把足量的小苏打固体和少量的过氧化钠固体混合均匀后充分加热,最后留下的固体物质的化学式是( )
| A、Na2CO3 |
| B、NaOH和Na2CO3 |
| C、Na2O2和Na2CO3 |
| D、Na2O2、NaOH和Na2CO3 |
下列物质中,只含离子键的是( )
| A、NH4Cl |
| B、CaCl2 |
| C、HCl |
| D、NaOH |
铜粉放入稀硫酸溶液中,加热后无明显现象发生.当加入或通入下列某物质后,铜粉的质量保持不变,则该物质是( )
| A、Fe2 (SO4)3 |
| B、O2 |
| C、Cu (NO3)2 |
| D、FeCl2 |
 乙醇是一种非常重要的烃的衍生物,是无色有特殊气味的液体.某校化学兴趣小组对乙醇的结构和性质进行了以下探究,请你参与并完成对有关问题的解答.
乙醇是一种非常重要的烃的衍生物,是无色有特殊气味的液体.某校化学兴趣小组对乙醇的结构和性质进行了以下探究,请你参与并完成对有关问题的解答.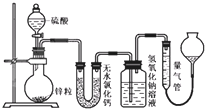 不同浓度的硫酸与锌反应时,产物不同,为了验证这一事实,某同学拟用如图装置进行实验(假设实验条件为压强为101kPa,温度为0℃).
不同浓度的硫酸与锌反应时,产物不同,为了验证这一事实,某同学拟用如图装置进行实验(假设实验条件为压强为101kPa,温度为0℃).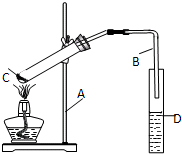 实验室制乙酸乙脂的装置如图:
实验室制乙酸乙脂的装置如图: