题目内容
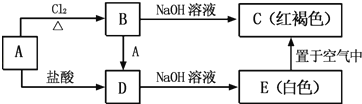
【题目】下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。下列说法错误的是( )

A.装置A烧瓶内的试剂可以是KMnO4
B.装置B具有除杂和贮存气体的作用
C.实验结束后,振荡D会观察到液体分层且下层呈紫红色
D.利用该装置能证明氯、溴、碘的非金属性逐渐减弱
【答案】C
【解析】
实验室制备氯气,二氧化锰与浓盐酸在加热条件下反应生成氯气、氯化锰和水;也可以高锰酸钾与浓盐酸在常温下反应生成氯气、氯化锰、氯化钾和水;制备的氯气中含有氯化氢气体杂质和水蒸气,可用饱和食盐水除去氯化氢气体,用浓硫酸干燥,用氢氧化钠尾气处理。
A. 根据装置图,装置A没有加热,故烧瓶内的试剂可以是KMnO4,高锰酸钾与浓盐酸反应的化学反应方程式为:2KMnO4+16HCl(浓)=2KCl+5Cl2↑+2MnCl2+8H2O,A正确;
B. 制备的氯气中含有少量挥发出来的氯化氢气体,可用饱和食盐水除去,故根据装置图,装置B具有除杂和贮存气体的作用,B正确;
C. 根据萃取原理,苯的密度比水小,故振荡D会观察到液体分层且上层呈紫红色,C错误;
D. 根据装置C、D中的颜色变化可知,装置A制备出来的氯气,与装置C中的溴化钠反应生成溴单质,将生成的液溴滴加到D装置,可生成碘单质,证明氯、溴、碘的非金属性逐渐减弱,D正确;故答案为:C。

练习册系列答案
 特高级教师点拨系列答案
特高级教师点拨系列答案
相关题目