题目内容
2.某同学实验探究氨气的还原性并进行系列实验.(1)将光亮的紫红色铜丝绕几圈后,在酒精灯火焰上加热,等铜丝变黑后,趁热将铜丝插入疏松的氯化铵晶体里,即刻发现有白色烟雾生成,拿出铜丝后,铜丝又转变为光亮的紫红色.在焊接铜器时用氯化铵除去铜器表面的氧化铜即利用了该原理,请完成该反应:
4CuO+2NH4Cl $\frac{△}{\;}$3Cu+1 CuCl2+1N2↑+4(H2O)
(2)利用下列装置,进行与金属氧化物MxOy反应生成M、H2、H2O,通过测量生成水的质量来测定M的相对原子质量.a中试剂是浓氨水.

①仪器a的名称为分液漏斗,仪器b中装人的试剂可以是氢氧化钠固体或碱石灰.
②按气流方向正确的装置连接顺序为(填序号,装置可重复使用):BDADC.
③实验结束时,应首先Ⅱ(填序号).
I.熄灭A装置的酒精灯 II.停止从a中滴加液体
④若实验中准确称取金属氧化物的质量为m g,完全反应后,测得生成水的质量为n g,则M的相对原子质量为$\frac{(18m-16n)y}{nx}$(用含X、y、m、n的式子表示).
(3)若金属氧化物MxOy为Fe2O3,将反应后固体溶于稀硫酸,然后滴加KSCN溶液没发生明显变化.推测该固体成分可能是(将化学式填入表,你认为有几种可能填几种).
| 序号 | 固体成分(填化学式) |
| 1 | |
| 2 | |
| 3 |
分析 (1)依据化合价升降法进行配平,结合电子守恒和原子守恒书写化学方程式;
(2)①仪器名称为分液漏斗,仪器b中加入的是氢氧化钠固体或碱石灰,吸收水蒸气得到干燥的氨气;
②从发生装置中出来的氨气带有水蒸气,必须干燥,故B接D,D接A,吸收反应生成的水用装置D,最后空气中的水不能进入装置D,所以需要装置C;
③实验结束时应首先停止从a中滴加液体,没有必要有多余的氨气制备出;
④由MxOy~YH2O关系计算得到M的相对原子质量;
(3)若金属氧化物MxOy为Fe2O3,将反应后固体溶于稀硫酸,然后滴加KSCN溶于没有发生变化,说明溶液中没有三价铁离子,反应后的固体成分可能为铁或是铁和氧化铁混合物,因为Fe+2Fe3+=3Fe2+.
解答 解:(1)依据反应前后原子守恒可知生成物缺项为生成的水,CuO+NH4Cl-Cu+CuCl2+N2↑+H2O,铜元素化合价+2价变化为0价,化合价降低,氮元素化合价-3价变化为0价,元素化合价升高,最小公倍数为6,则电子守恒和原子守恒配平书写得到化学方程式为4CuO+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+CuCl2+N2↑+4 H2O,
故答案为:4;2;3;1;1;4H2O;
(2)通过测量生成水的质量来测定M的相对原子质量.a中试剂是浓氨水,
①仪器a名称为分液漏斗用来盛放和滴加液体,a中试剂是浓氨水,仪器b中加入的是氢氧化钠固体或碱石灰,滴入浓氨水固体溶解放热使一水合氨分解生成氨气,
故答案为:分液漏斗;氢氧化钠固体或碱石灰;
②从发生装置中出来的氨气带有水蒸气,必须干燥,故B接D,D接A,吸收反应生成的水用装置D,最后空气中的水不能进入装置D,所以需要装置C,按气流方向正确的装置连接顺序为BDADC,
故答案为:BDADC;
③实验结束时应首先停止从a中滴加液体,熄灭A装置的酒精灯,
故答案为:Ⅱ;
④若实验中准确称取金属氧化物的质量为mg,完全反应后,测得生成水的质量为ng,
由MxOy~YH2O关系计算
xM+16y 18y
mg ng
M=$\frac{(18m-16n)y}{nx}$,
则M的相对原子质量为$\frac{(18m-16n)y}{nx}$,
故答案为:$\frac{(18m-16n)y}{nx}$;
(3)若金属氧化物MxOy为Fe2O3,将反应后固体溶于稀硫酸,然后滴加KSCN溶于没有发生变化,说明溶液中没有三价铁离子,反应后的固体成分可能为铁或是铁和氧化铁混合物,因为Fe+2Fe3+=3Fe2+,
故答案为:
| 序号 | 固体成分(填化学式) |
| 1 | Fe |
| 2 | Fe和Fe2O3 |
| 3 |
点评 本题考查了物质组成和产物的实验测定和分析判断,主要是实验过程、实验现象、实验装置连接和顺序的理解应用,掌握基础是解题关键,题目难度中等.

| A. | 若管道漏气遇氨就会产生白烟 | B. | 该反应利用了Cl2的强氧化性 | ||
| C. | 生成1molN2有6mol电子转移 | D. | 该反应属于复分解反应 |
| A. | NaCl | B. | MgCl2 | C. | NaHCO3 | D. | H2CO3 |
| X | Y | Z |
| R | W |
| A. | X,Y、R,W四种元素的原于半径依次增大 | |
| B. | Z、W元素与X均可以形成AB2型化合物 | |
| C. | Y元素的最高价氧化物的水化物和其氢化物反应的生成物中仅含有共价键 | |
| D. | Z的氢化物的稳定性大于W的氢化物,是因为Z的氢化物分子间存在氢键 |
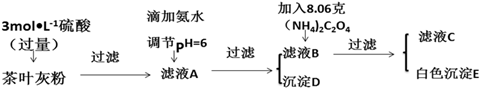
请回答下列有关问题:
(1)文献资料显示,某些金属离子的氢氧化物完全沉淀的pH为:
| 离子 | Ca2+ | Fe3+ |
| 完全沉淀时的pH | 13 | 4.1 |
(2)写出从滤液A→沉淀D的离子反应方程式Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+.
(3)为保证实验精确度,沉淀D及E需要分别洗涤,并将洗涤液转移回母液中,判断D已经沉淀完全方法是静置,向上层清液中继续滴加氨水若无红褐色沉淀生成则说明D已沉淀完全,否则未沉淀完全.
(4)用KMnO4标准溶液滴定C溶液时所发生的反应为:5C2O42-+2MnO4-+16H+═10CO2↑+2Mn2++8H2O.
现将滤液C稀释至500mL,再取其中的25.00mL溶液,用硫酸酸化后,用0.1000mol•L-1的KMnO4标准溶液滴定,终点时消耗KMnO4溶液10.00mL.

①此步操作过程中KMnO4标准溶液应装在图2中哪个仪器中(填写字母)B.
②滴定到终点,现象无色变为浅红色,静置后,如图3方法读取KMnO4标准溶液的刻度数据,则测定的钙元素含量将偏高(填“偏高”“偏低”或“无影响”).
(5)原茶叶中钙元素的质量分数为0.3%.
| 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 水溶性 | |
| 苯甲酸 | 122.4 | 249 | 1.27 | 微溶 |
| 甲醇 | -97 | 64.3 | 0.79 | 互溶 |
| 苯甲酸甲酯 | -12.3 | 199.6 | 1.09 | 不溶 |
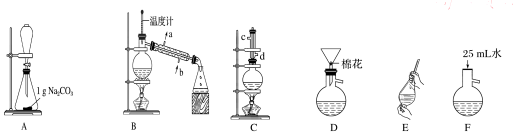
(1)在烧瓶中混合有机物及浓硫酸的方法是先将一定量的苯甲酸放入烧瓶中,然后再加入甲醇,最后边振荡边缓慢加入一定量的浓硫酸,装置C如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是冷却后补加.
(2)B装置的冷凝管的主要作用是冷凝收集产品,可否换为球形冷凝管否(填“可”或“否”).
(3)制备和提纯苯甲酸甲酯的操作先后顺序为CFEADB(填装置字母代号).
(4)A中Na2CO3的作用是除去苯甲酸甲酯中的苯甲酸;D装置的作用是除去没有反应完的Na2CO3
(5)在洗涤、分液操作中,应充分振荡,然后静置,待分层后b(填标号).
a.直接将苯甲酸甲酯从分液漏斗的上口倒出
b.直接将苯甲酸甲酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将苯甲酸甲酯从下口放出
d.先将水层从分液漏斗的下口放出,再将苯甲酸甲酯从上口倒出.
| A. | 在0.1mol•L-1氨水中加几滴酚酞,再加等体积的醋酸铵溶液,观察红色是否变浅 | |
| B. | 测定0.1 mol•L-1NH4C1溶液的酸碱性 | |
| C. | 测定0.lmol•L-1氨水的pH | |
| D. | 比较浓度均为0.1 mol•L -1的氨水与NaOH溶液的导电能力 |
 如图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态).由图可知Mg与卤素单质的反应均为放热(填“放热”或“吸热”)反应.
如图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态).由图可知Mg与卤素单质的反应均为放热(填“放热”或“吸热”)反应.