��Ŀ����
2CO(g)+O2(g)=2CO2(g) ��H=-566kJ/mol
2H2(g)+O2(g)=2H2O(g) ��H=-483.6kJ/mol
(1)д�����淴Ӧһ����̼��ˮ������Ӧ���ɶ�����̼���������Ȼ�ѧ����ʽ��________________��
(2)�CO(g)+H2O(g)
 CO2(g)+H2(g)��ƽ�ⳣ������ʽ��__________����ij�¶�ʱK=1��ijʱ�̲�ø��¶����ܱ������и����ʵ����ʵ���Ũ�ȼ���
CO2(g)+H2(g)��ƽ�ⳣ������ʽ��__________����ij�¶�ʱK=1��ijʱ�̲�ø��¶����ܱ������и����ʵ����ʵ���Ũ�ȼ��� 
A.v(��)>v(��)B��v(��)<v(��)C.v(��)=v(��)D����ȷ��
���ⶨ����ij�����ڸ����ʵ����ʵ���Ũ��(mol/L)�仯���

(4)4~5min��5~6min֮����ܸı�������ֱ���__________������ţ���
A��ʹ�ô���������CO2Ũ�� B�������¶ȡ�����H2OŨ�� C�������¶ȡ���Сѹǿ
 CO2(g)+H2(g) ��H=-41.2kJ/mol
CO2(g)+H2(g) ��H=-41.2kJ/mol(2)
 ��A
��A (3)0.04mol/(L��min)��0.12
(4)B

 �ƸԹھ��ο���ϵ�д�
�ƸԹھ��ο���ϵ�д��ҹ��Ǹ��������,��������Ϊ�����һ,��¯��������Ϊ�ձ����������.
I. ��֪��2CO(g)+ O2(g)��2CO2(g),��H��-566 kJ��mol-1
2Fe(s)+ 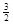 O2(g)��Fe2O3(s),��H��-825.5
kJ��mol-1
O2(g)��Fe2O3(s),��H��-825.5
kJ��mol-1
 ��Ӧ��Fe2O3(s)+
3CO(g)
��Ӧ��Fe2O3(s)+
3CO(g)  2Fe(s)+ 3CO2(g),��H��______ kJ��mol-1.
2Fe(s)+ 3CO2(g),��H��______ kJ��mol-1.
��. ��Ӧ
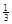 Fe2O3(s)+ CO(g)
Fe2O3(s)+ CO(g)
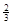 Fe(s)+ CO2(g)��1000���ƽ�ⳣ������4.��һ���ݻ�Ϊ10L���ܱ�������,1000��ʱ����Fe��Fe2O3��CO��CO2��1.0mol,��Ӧ����l0min��ﵽƽ��.
Fe(s)+ CO2(g)��1000���ƽ�ⳣ������4.��һ���ݻ�Ϊ10L���ܱ�������,1000��ʱ����Fe��Fe2O3��CO��CO2��1.0mol,��Ӧ����l0min��ﵽƽ��.
��1��CO��ƽ��ת����=____________.
��2�������CO��ƽ��ת����,�ٽ�Fe2O3��ת��,�ɲ�ȡ�Ĵ�ʩ��________.
a����߷�Ӧ�¶�
b������Ӧ��ϵ��ѹǿ
c��ѡȡ���ʵĴ���
d����ʱ���ջ��Ƴ�����CO2
e�������ʯ,ʹ����ƽ���������ֽӴ�
��.��¯���������ķ����е�CO�ɽ��л���,ʹ����һ�������º�H2��Ӧ�Ʊ��״�:
CO(g)+
2H2(g)  CH3OH(g).�����ͼʾ�ش���������:
CH3OH(g).�����ͼʾ�ش���������:
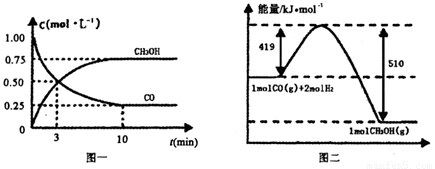
��1���ӷ�Ӧ��ʼ��ƽ��,��H2Ũ�ȱ仯��ʾƽ����Ӧ����v(H2)=________.
��2�������¶Ⱥ�������ͬ�������ܱ�������,����ͬ��ʽͶ�뷴Ӧ��,��÷�Ӧ�ﵽƽ�ⅼ���й��������±���
|
���� |
��Ӧ��Ͷ����� |
��Ӧ��� ת���� |
CH3OH��Ũ�� |
�����仯 (Q1��Q2��Q3������0) |
|
�� |
1mol CO��2mol H2 |
��1 |
c1 |
�ų�Q1kJ���� |
|
�� |
1mol CH3OH |
��2 |
c2 |
����Q2kJ���� |
|
�� |
2mol CO��4mol H2 |
��3 |
c3 |
�ų�Q3kJ���� |
�����й�ϵ��ȷ����________.
A��c1=c2
B��2Q1=Q3
C��2a1=a3
D��a1 +a2 =1
E���÷�Ӧ������1mol CH3OH����ų�(Q1+Q2)kJ����
��3������һ����ɱ���ܱ������г���l molCO��2molH2��1molCH3OH,�ﵽƽ�ⅼ��û��������ܶ���ͬ��ͬѹ����ʼ��1.6��,��÷�Ӧ��________(����������桱)��Ӧ�����ƶ�.
��4���״�������������ȼ�ϵ��,�õ���ö�Ķ��Ե缫����Ũ����������Һ,д���õ�صĸ�����Ӧʽ______________________.
.(13��)�ҹ��Ǹ��������,��������Ϊ�����һ,��¯��������Ϊ�ձ����������.
I.��֪��2CO(g)+ O2(g)��2CO2(g),��H��-566 kJ��mol-1
2Fe(s)+
 O2(g)��Fe2O3(s),��H��-825.5 kJ��mol-1
O2(g)��Fe2O3(s),��H��-825.5 kJ��mol-1
��Ӧ��Fe2O3(s)+
3CO(g) 2Fe(s)+ 3CO2(g),��H��______ kJ��mol-1.
2Fe(s)+ 3CO2(g),��H��______ kJ��mol-1.
��.��Ӧ 1/3Fe2O3(s)+
CO(g) 2/3Fe(s)+ CO2(g)��1000���ƽ�ⳣ������4.��һ���ݻ�Ϊ10L���ܱ�������,1000��ʱ����Fe��Fe2O3��CO��CO2��1.0mol,��Ӧ����l0min��ﵽƽ��.
2/3Fe(s)+ CO2(g)��1000���ƽ�ⳣ������4.��һ���ݻ�Ϊ10L���ܱ�������,1000��ʱ����Fe��Fe2O3��CO��CO2��1.0mol,��Ӧ����l0min��ﵽƽ��.
(1)CO��ƽ��ת����=____________.
(2)�����CO��ƽ��ת����,�ٽ�Fe2O3��ת��,�ɲ�ȡ�Ĵ�ʩ��________.
a����߷�Ӧ�¶� b������Ӧ��ϵ��ѹǿ
c��ѡȡ���ʵĴ��� d����ʱ���ջ��Ƴ�����CO2
e�������ʯ,ʹ����ƽ���������ֽӴ�
��.��¯���������ķ����е�CO�ɽ��л���,ʹ����һ�������º�H2��Ӧ�Ʊ��״�:
CO(g)+
2H2(g) CH3OH(g).�����ͼʾ�ش���������:
CH3OH(g).�����ͼʾ�ش���������:

(1)�ӷ�Ӧ��ʼ��ƽ��,��H2Ũ�ȱ仯��ʾƽ����Ӧ����v(H2)=________.
(2)�����¶Ⱥ�������ͬ�������ܱ�������,����ͬ��ʽͶ�뷴Ӧ��,��÷�Ӧ�ﵽƽ�ⅼ���й��������±�:
|
���� |
��Ӧ��Ͷ����� |
��Ӧ��� ת���� |
CH3OH��Ũ�� |
�����仯 (Q1��Q2��Q3������0) |
|
�� |
1mol CO��2mol H2 |
��1 |
c1 |
�ų�Q1 kJ���� |
|
�� |
1mol CH3OH |
��2 |
c2 |
����Q2 kJ���� |
|
�� |
2mol CO��4mol H2 |
��3 |
c3 |
�ų�Q3 kJ���� |
�����й�ϵ��ȷ����________.
A c1=c2 B.2Q1=Q3 C. 2��1=��2 D. ��1+��2=1
E. �÷�Ӧ������1mol CH3OH����ų�(Q1+Q2)kJ����
(3)����һ����ɱ���ܱ������г���l mol CO��2mol H2��1mol CH3OH,�ﵽƽ�ⅼ��û��������ܶ���ͬ��ͬѹ����ʼ��1.6��,��÷�Ӧ��________(����������桱)��Ӧ�����ƶ�.
(4)�״�������������ȼ�ϵ��,�õ���ö�Ķ��Ե缫����Ũ����������Һ,д���õ�صĸ�����Ӧʽ___ ____��
 2Fe(s)��3CO2(g) ��H��_______kJ/mol��
2Fe(s)��3CO2(g) ��H��_______kJ/mol��  2/3 Fe(s)��CO2(g)��1000���ƽ�ⳣ������4.0����һ���ݻ�Ϊ10L���ܱ������У�1000��ʱ����Fe��Fe2O3��CO��CO2��1.0mol����Ӧ����10min��ﵽƽ�⡣
2/3 Fe(s)��CO2(g)��1000���ƽ�ⳣ������4.0����һ���ݻ�Ϊ10L���ܱ������У�1000��ʱ����Fe��Fe2O3��CO��CO2��1.0mol����Ӧ����10min��ﵽƽ�⡣  �������ͼʾ�ش��������⣺
�������ͼʾ�ش��������⣺ 
