题目内容
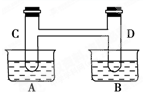 如右图所示,在容器A中装有20℃的水50mL,容器B中装有1mol/L的盐酸50mL,试管C、D相连通.其中装有红棕色NO2和无色N2O4的混合气体,并处于下列平衡:2NO2?N2O4△H=-57kJ/mol;当向A中加入50g NH4NO3晶体使之溶解;向B中加入2g苛性钠时:
如右图所示,在容器A中装有20℃的水50mL,容器B中装有1mol/L的盐酸50mL,试管C、D相连通.其中装有红棕色NO2和无色N2O4的混合气体,并处于下列平衡:2NO2?N2O4△H=-57kJ/mol;当向A中加入50g NH4NO3晶体使之溶解;向B中加入2g苛性钠时:(1)C中的气体颜色
(2)25℃时,2NO2??N2O4达到平衡时,c(NO2)=0.012 5mol/L,c(N2O4)=0.032 1mol/L,则NO2的起始浓度为
分析:(1)硝酸铵的溶解过程是吸热过程,氢氧化钠溶于是放热、与盐酸反应放出热量,结合温度对平衡移动的影响判断;
(2)令二氧化氮的初始浓度为cmol/L,利用三段式计算解答.
(2)令二氧化氮的初始浓度为cmol/L,利用三段式计算解答.
解答:解:(1)A中硝酸铵的溶解过程是吸热过程,溶解后C中温度降低,化学平衡2NO2?N2O4,△H=-57kJ/mol,会向着正反应方向进行,所以颜色变浅,
D中氢氧化钠溶于是放热、与盐酸反应放出热量,温度升高,平衡向逆反应方向移动,二氧化氮的浓度增大,颜色变深,
故答案为:变浅;变深;
(2)设:二氧化氮的初始浓度为cmol/L,根据题意信息可知:
2NO2 ?N2O4
初始浓度(mol/L):c 0
变化浓度(mol/L):c-0.0125 0.0321
平衡时浓度(mol/L):0.0125 0.0321
则c-0.0125=2×0.0321,解得c=0.0767mol/L,
NO2的转化率为
×100%≈83.7%.
故答案为:0.0767mol/L;83.7%.
D中氢氧化钠溶于是放热、与盐酸反应放出热量,温度升高,平衡向逆反应方向移动,二氧化氮的浓度增大,颜色变深,
故答案为:变浅;变深;
(2)设:二氧化氮的初始浓度为cmol/L,根据题意信息可知:
2NO2 ?N2O4
初始浓度(mol/L):c 0
变化浓度(mol/L):c-0.0125 0.0321
平衡时浓度(mol/L):0.0125 0.0321
则c-0.0125=2×0.0321,解得c=0.0767mol/L,
NO2的转化率为
| 0.767mol/L-0.0125mol/L |
| 0.0767mol/L |
故答案为:0.0767mol/L;83.7%.
点评:本题考查化学平衡计算、影响化学平衡移动的因素,难度不大,注意对基础知识理解掌握与灵活应用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 (2009?泰州模拟)二氧化硫是常用的化工原料,但也是大气的主要污染物.
(2009?泰州模拟)二氧化硫是常用的化工原料,但也是大气的主要污染物. (1)美国“阿特兰蒂斯号”航天飞机与2009年5月11日升空修复含勃望远镜,它使用的燃料是液氢和液氧.已知下列热化学方程式:
(1)美国“阿特兰蒂斯号”航天飞机与2009年5月11日升空修复含勃望远镜,它使用的燃料是液氢和液氧.已知下列热化学方程式:
