题目内容
12.下列实验能获得成功的是( )| 实验目的 | 实验步骤 | |
| A | 比较CH3COOH和H2CO3酸性强弱 | 测同浓度的Na2CO3、CH3COONa溶液的pH |
| B | 比较S和Si非金属性强弱 | 向Na2SiO3溶液中通入SO2出现浑浊 |
| C | 除去KNO3中少量NaCl | 将混合物制成热的饱和溶液,冷却结晶、过滤 |
| D | 探究蔗糖水解产物中是否含有葡萄糖 | 取少量蔗糖溶液加稀硫酸,水浴加热几分钟后,再加入新制的氢氧化铜悬浊液并加热 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.当醋酸钠与碳酸钠的浓度相同时,醋酸钠溶液的碱性强,说明醋酸的酸性大于碳酸氢根离子的酸性;
B.亚硫酸不是最高价含氧酸,利用最高价含氧酸的酸性比较非金属性;
C.二者的溶解度受温度影响不同;
D.水解后检验葡萄糖,应在碱性溶液中.
解答 解:A.根据盐的水解规律:越弱越水解,当醋酸钠与碳酸钠的浓度相同时,醋酸钠溶液的碱性强,说明醋酸的酸性大于碳酸氢根离子的酸性,不能说明醋酸的酸性大于碳酸的酸性,应把醋酸钠溶液与碳酸氢钠溶液的pH做比较,故A错误;
B.向硅酸钠溶液中通入SO2气体,产生硅酸沉淀,说明亚硫酸的酸性比硅酸强,但亚硫酸不是S的最高价氧化物的水化物,无法由此判断S和Si非金属性强弱,故B错误;
C.利用硝酸钾和氯化钠的溶解度随温度变化的不同,将混合物制成热的饱和溶液,冷却结晶,过滤,得到的晶体为纯净的硝酸钾,故C正确;
D.蔗糖在酸性条件下水解生成葡萄糖,葡萄糖与氢氧化铜浊液的反应应在碱性条件下进行,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、反应原理、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
3.下列说法正确的是( )
| A. | 按系统命名法,化合物 的名称是2,5,5-三甲基-3-乙基庚烷 的名称是2,5,5-三甲基-3-乙基庚烷 | |
| B. | 将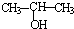 与NaOH的醇溶液共热可制备CH3-CH═CH2 与NaOH的醇溶液共热可制备CH3-CH═CH2 | |
| C. | 向柠檬醛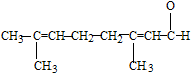 中加入酸性高锰酸钾,若溶液褪色,说明分子中含有醛基 中加入酸性高锰酸钾,若溶液褪色,说明分子中含有醛基 | |
| D. | 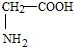 、 、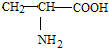 、 、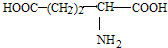 三种氨基酸脱水,最多可生成6种二肽 三种氨基酸脱水,最多可生成6种二肽 |
20.支撑“宇宙大爆炸”理论的重要事实之一是( )
| A. | 宇宙原子总数的88.6%是氢 | B. | 地球上的元素绝大多数是金属 | ||
| C. | 普鲁特“氢是元素之母”的预言 | D. | 宇宙中存在少量稀有气体分子 |
7.下列实验操作正确的是( )
| A. | 蒸发时应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 过滤时,将待过滤的物质沿玻璃棒倒入过滤器时,玻璃棒下端应靠在三层滤纸处 | |
| C. | 分液操作时,下层液体从分液漏斗下口放出后,再将上层液体从下口放出到另一个烧杯中 | |
| D. | 蒸馏操作时,温度计应插入在溶液中 |
4.X、Y、Z是三种短周期元素,其中X、Y位于同一主族,Y、Z处于同一周期.X原子的最外层电子数是其电子层数的3倍.Z原子的核外电子数比Y原子少l.下列说法正确的是( )
| A. | 三种元素的氢化物中只有极性键没有非极性键 | |
| B. | Y元素最高价氧化物对应水化物的化学式可表示为H3YO4 | |
| C. | 三种元素的气态最简单氢化物中Z的氢化物最稳定 | |
| D. | 原子半径由大到小的顺序为Z>Y>X |
1.某种溶液仅含下表离子中的5种(不考虑水的电离与离子水解),且各种离子的物质的量均为1mol.
若向原溶液中加入足量的盐酸,有无色气体生成.经分析反应后溶液中阴离子的种类没有变化.
(1)溶液中一定不(填“一定”、“一定不”或“可能”)含有HCO3-或CO32-,理由是HCO3-与CO32-均可与盐酸反应生成二氧化碳,造成阴离子种类有所变化.
(2)原溶液中所含的阴离子为Cl-、NO3-、SO42-,阳离子为Fe2+、Mg2+.
(3)向原溶液中加入足量的盐酸,有无色气体生成的离子反应方程式为3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O.
(4)若向原溶液中加入足量的氢氧化钠溶液,充分反应后将沉淀过滤、洗涤、干燥灼烧至恒重,得到固体质量为120g.
| 阳离子 | K+ Ba2+ Fe2+ Al3+ Fe3+ Mg2+ |
| 阴离子 | OH- HCO3- CO32- Cl- NO3- SO42- |
(1)溶液中一定不(填“一定”、“一定不”或“可能”)含有HCO3-或CO32-,理由是HCO3-与CO32-均可与盐酸反应生成二氧化碳,造成阴离子种类有所变化.
(2)原溶液中所含的阴离子为Cl-、NO3-、SO42-,阳离子为Fe2+、Mg2+.
(3)向原溶液中加入足量的盐酸,有无色气体生成的离子反应方程式为3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O.
(4)若向原溶液中加入足量的氢氧化钠溶液,充分反应后将沉淀过滤、洗涤、干燥灼烧至恒重,得到固体质量为120g.
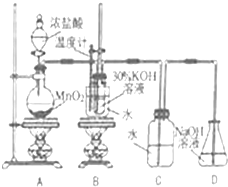 某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验.
某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验.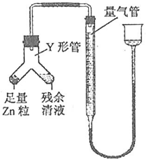 .
.