题目内容
2.200mL 0.3mol•L-1的K2SO4溶液和100mL 0.2mol•L-1的Fe2(SO4)3溶液混合后,若忽略液体混合时体积的变化,则溶液中SO${\;}_{4}^{2-}$的物质的量浓度为( )| A. | 0.3 mol•L-1 | B. | 0.4 mol•L-1 | C. | 0.45 mol•L-1 | D. | 0.5 mol•L-1 |
分析 先根据n=cV分别计算出两溶液中硫酸钾、硫酸铁的物质的量,然后结合溶质的化学式计算出混合液中硫酸根离子的总物质的量,最后根据c=$\frac{n}{V}$计算出混合液中硫酸根离子的物质的量浓度.
解答 解:200mL 0.3mol•L-1的K2SO4溶液中含有溶质硫酸钾的物质的量为:0.3mol/L×0.2L=0.06mol,含有硫酸根离子的物质的量为0.06mol,
100mL 0.2mol•L-1的Fe2(SO4)3溶液中含有硫酸铁的物质的量为:0.2mol/L×0.1L=0.02mol,含有硫酸根离子的物质的量为:0.02mol×3=0.06mol,
混合液中含有硫酸根离子的总物质的量为:0.06mol+0.06mol=0.12mol,
则混合液中硫酸根离子的物质的量浓度为:$\frac{0.12mol}{0.2L+0.1L}$=0.4mol/L,
故选B.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确物质的量浓度的概念及表达式为解答关键,注意掌握溶质浓度与含有离子的浓度的关系,试题侧重考查学生的分析能力及化学计算能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15.下列同组中的两种物质,属于官能团异构的是( )
| A. | CH3CH2CH2OH和 CH3CH(OH)CH3 | |
| B. | CH3CH(CH3)2和CH3CH2CH2CH3 | |
| C. | CH3CH2OH和CH3OCH3 | |
| D. | CH2=CHCH2CH2CH3和CH3CH2CH=CHCH3 |
16.同周期的三种非金属元素X、Y、Z,它们的原子半径由小到大的顺序为X<Y<Z,则下列判断中正确的是( )
| A. | 非金属性X<Y<Z | |
| B. | 气态氢化物的热稳定性按X、Y、Z顺序减弱 | |
| C. | X、Y、Z的最高价氧化物对应水化物酸性由弱到强 | |
| D. | X、Y、Z最外层电子数依次减少 |
17.在一定条件下发生反应3A(g)+2B(g)?zC(g)+2D(g),在2L的密闭容器中把4mol A和2mol B混合,2min后反应达到平衡时生成1.6mol C,又测得反应速率v(D)=0.2mol•L-1•min-1.则下列说法不正确的是( )
| A. | z=4 | B. | B的转化率是40% | ||
| C. | A的平衡浓度是1.4 mol•L-1 | D. | 平衡时气体压强是原来的1.2倍 |
14.H-H键的键能是436kJ•mol -1,Br-Br键的键能是194kJ•mol -1,H-Br键的键能是356kJ•mol -1.则对反应H2(g)+Br2(g)?2HBr(g)的说法,不正确的是( )
| A. | 吸热反应 | B. | 放热反应 | C. | 化合反应 | D. | 可逆反应 |
11.下列叙述正确的是( )
| A. | Fe分别与氯气和稀盐酸反应所得氯化物相同 | |
| B. | K、Zn分别与不足量的稀硫酸反应所得溶液均呈中性 | |
| C. | C、P、S、Cl的最高价氧化物对应水化物的酸性逐渐增强 | |
| D. | Li、Na、K的原子半径和密度随原子序数的增加而增大 |
12.关于1-溴丙烷和2-丙醇分别发生消去反应的有关说法不正确的是( )
| A. | 碳氢键断裂的位置不相同 | |
| B. | 反应条件相同 | |
| C. | 反应产生的气体经净化处理后,均能使酸性高锰酸钾溶液褪色 | |
| D. | 产物相同 |
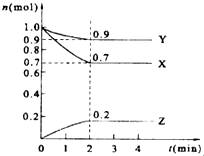 某温度时,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.