题目内容
| A、c(K+)=2c(SO32-)+c(HSO3-) | B、c(OH-)+c(SO32-)=c(H+)+c(H2SO3) | C、c(K+)>c(SO32-)>c(H2SO3) | D、溶液pH<7 |
A.根据物料守恒得c(K+)=c(SO32-)+c(HSO3-)+c(H2SO3),故A错误;
B.根据物料守恒得c(K+)=c(SO32-)+c(HSO3-)+c(H2SO3),根据电荷守恒得c(K+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),所以得c(OH-)+c(SO32-)=c(H+)+c(H2SO3),故B正确;
C.溶液中的溶质是亚硫酸氢钾,HSO3-的电离程度大于水解程度,所以c(SO32-)>c(H2SO3),钾离子不水解,所以离子浓度大小顺序是c(K+)>c(SO32-)>c(H2SO3),故C正确;
D.溶液中的溶质是亚硫酸氢钾,HSO3-的电离程度大于水解程度,溶液溶液呈酸性,则pH<7,故D正确;
故选:A.

 一本好题口算题卡系列答案
一本好题口算题卡系列答案(8分)最近雾霾天气又开始肆虐我国大部分地区。其中SO2是造成空气污染的主要原因,利用钠碱循环法可除去SO2。
(1)钠碱循环法中,吸收液为Na2SO3溶液,该吸收反应的离子方程式是
(2)已知H2SO3的电离常数为 K1=1.54×10-2 , K2=1.02×10-7, H2CO3的电离常数为 K1=4.30×10-7, K2= 5.60×10-11,则下列微粒可以共存的是_____________。
A.CO32- HSO3- B.HCO3- HSO3-
C.SO32- HCO3- D.H2SO3 HCO3-
(3)吸收液吸收SO2的过程中,pH随n(SO3²﹣):n(HSO3﹣)变化关系如下表:
|
n(SO3²﹣):n(HSO3﹣) |
91 :9 |
1 :1 |
1 :91 |
|
pH |
8.2 |
7.2 |
6.2 |
①上表判断NaHSO3溶液显 性,从原理的角度解释原因
②在NaHSO3溶液中离子浓度关系不正确的是(选填字母):
A.(Na+)= 2c(SO32-)+ c(HSO3-),
B.(Na+)> c(HSO3-)> c(H+)> c(SO32-)> c(OH-),
C.(H2SO3)+ c(H+)= c(SO32-)+ (OH-),
D.(Na+)+ c(H+)= 2 c(SO32-)+ c(HSO3-)+ c(OH-)
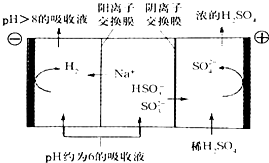
(4)当吸收液的pH降至约为6时,需送至电解槽再生 。再生示意图如下:

① 吸收液再生过程中的总反应方程式是 。
② 当电极上有1mol电子转移时阴极产物为 克.
最近雾霾天气肆虐我国大部分地区。其中SO2是造成空气的污染的主要原因,利用钠碱循环法可除去SO2。
(1)钠碱循环法中,吸收液为Na2SO3溶液,该反应的离子方程式是________。
(2)已知H2SO3的电离常数为K1=1.54×10-2,K2=1.024×10-7;H2CO3的电离常数为K1=4.30×10-7,K2=5.60×10-11,则下列微粒可以大量共存的是______(填序号)。
A.CO32- HSO3- B. HCO3- HSO3- C. SO32- HCO3- D. H2SO3 HCO3-
(3)吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
|
n(SO32-):n(HSO3-) |
91:9 |
1:1 |
1:91 |
|
pH |
8.2 |
7.2 |
6.2 |
①根据上表判断NaHSO3溶液显_______性,试解释原因__________________________;
②在NaHSO3溶液中离子浓度关系不正确的是_______(填序号)。
A.c(Na+)=2c(SO32-)+c(HSO3-)
B.c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)
C.c(H2SO3)+ c(H+)=c(SO32-)+c(OH-)
D.c(Na+)+ c(H+)=2c(SO32-)+ c(HSO3-)+ c(OH-)
(4)当吸收液的pH降至约为6时,需送至电解槽处理,直至得到pH>8的吸收液再循环利用,电解示意图如下:
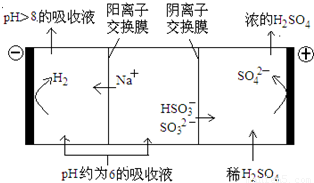
①写出阳极上发生的电极反应式____________;
②当电极上有1mol电子转移时阴极产物的质量为__________。
 最近雾霾天气肆虐我国大部分地区.其中SO2是造成空气的污染的主要原因,利用钠碱循环法可除去SO2.
最近雾霾天气肆虐我国大部分地区.其中SO2是造成空气的污染的主要原因,利用钠碱循环法可除去SO2.