题目内容
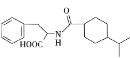
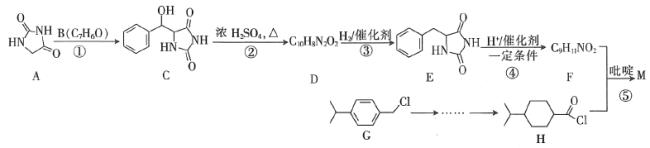
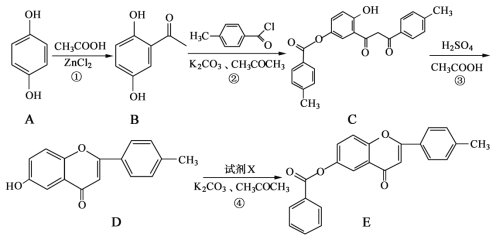
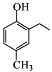
【题目】从冬青中提取出的有机物A可用于合成抗结肠炎药物Y及其他化学品,合成路线如下图:
提示:
根据上述信息回答:
(1)请写出Y中含氧官能团的名称:__________________。
(2)写出反应③的反应类型:_________________。
(3)写出下列反应的化学方程式:
②______________。
⑤_______________。
(4)A的同分异构体I和J是重要的医学中间体,在浓硫酸的作用下I和J分别生成![]() 和
和 ,鉴别I和J的试剂为_________________。
,鉴别I和J的试剂为_________________。
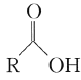
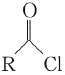
【答案】羧基、酚羟基 取代反应  +CO2+H2O
+CO2+H2O![]()
 +NaHCO3 2CH3OH+O2
+NaHCO3 2CH3OH+O2![]() 2HCHO+2H2O FeCl3溶液或饱和溴水
2HCHO+2H2O FeCl3溶液或饱和溴水
【解析】
A在足量的NaOH溶液中水解得到B和C,则A为酯,B在浓硫酸的作用下得到二甲醚,则B为CH3OH,甲醇发生催化氧化得到D(HCHO),甲醛与银氨溶液发生反应后,再酸化得到CO2;结合Y的结构简式和提示,可知G在浓硫酸作用下与浓硝酸发生硝化反应,引入硝基,再将-NO2还原为-NH2;A在碱性环境下水解得到醇和羧酸盐,E中含有-COONa,结合Y的结构结构,E中还含有-ONa;通入CO2,-ONa转化为-OH;再加入稀硫酸,-COONa转化为-COOH。则E为 ,F为
,F为 ,G为
,G为 ,H为
,H为 。
。
(1)从Y的结构简式可知,Y中的含氧官能团的名称为羧基、酚羟基;
(2)结合Y的结构简式和提示,可知G在浓硫酸作用下与浓硝酸发生硝化反应,也是取代反应;
(3)②E为 ,F为
,F为 ,在E的溶液中通入CO2,由于碳酸酸性强于苯酚弱于羧酸,因此可以将-ONa转化为-OH,而-COONa不变,反应生成NaHCO3,化学方程式为
,在E的溶液中通入CO2,由于碳酸酸性强于苯酚弱于羧酸,因此可以将-ONa转化为-OH,而-COONa不变,反应生成NaHCO3,化学方程式为 +CO2+H2O
+CO2+H2O![]()
 +NaHCO3
+NaHCO3
⑤B为甲醇,D为甲醛,反应⑤为醇的催化氧化,化学方程式为2CH3OH+O2![]() 2HCHO+2H2O;
2HCHO+2H2O;
(4)根据上述分析A的分子式为C8H8O3,在浓硫酸的作用下I和J分别生成![]() 和
和 ,则I和J的结构简式分别为
,则I和J的结构简式分别为 和
和 ,I和J的区别在于,I中的-OH直接与苯环相连,是酚羟基;J/span>中的-OH与侧链上的碳原子相连,是醇羟基;可以用FeCl3溶液或饱和溴水区别I和J;酚羟基遇FeCl3溶液呈现紫色;酚羟基的邻对位上的H原子能被-Br取代,生成白色沉淀。
,I和J的区别在于,I中的-OH直接与苯环相连,是酚羟基;J/span>中的-OH与侧链上的碳原子相连,是醇羟基;可以用FeCl3溶液或饱和溴水区别I和J;酚羟基遇FeCl3溶液呈现紫色;酚羟基的邻对位上的H原子能被-Br取代,生成白色沉淀。

【题目】(1)T1K时,将1mol二甲醚引入一个抽空的150L恒容容器中,发生分解反应:CH3OCH3(g)CH4(g)+H2(g)+CO(g)。
反应时间t/min | 0 | 6.5 | 13.0 | 26.5 | 52.6 | ∞ |
气体总压p总/kPa | 50.0 | 55.0 | 65.0 | 83.2 | 103.8 | 125.0 |
①由此计算:反应达平衡时,二甲醚的分解率为______,该温度下平衡常数Kc=______。(填数值)
②若升高温度,CH3OCH3的浓度增大,则该反应为______反应(填“放热”或“吸热”),在恒温恒容下,若要缩短上述反应达到平衡的时间,可采取的措施有______、______。
(2)在T2K、1.0×104kPa下,等物质的量的CO与CH4混合气体发生如下反应:CO(g)+CH4(g)CH3CHO(g)。反应速率v=v正v逆=k正p(CO)p(CH4)-k逆p(CH3CHO),k正、k逆分别为正、逆向反应速率常数,p为气体的分压(气体分压p=气体总压p总×体积分数)。用气体分压表示的平衡常数Kp=4.5×10-5(kPa)-1,当CO转化率为20%时,![]() =______。
=______。
(3)工业上常用高浓度的K2CO3溶液吸收CO2得到溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如图所示:
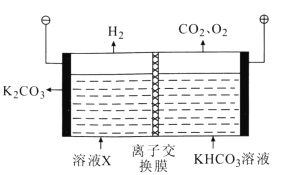
①在阳极区发生的反应包括(电极反应)______和H++![]() =CO2↑+H2O。
=CO2↑+H2O。
②用离子方程式表示![]() 在阴极区再生的过程:______。
在阴极区再生的过程:______。