题目内容
实验室制备Cl2的反应原理为:MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O
(1)当标准状况下生成11.2 L氯气时转移电子的物质的量为________.
(2)在此反应中氧化产物是________,氧化剂与还原剂的物质的量的比为________.
(3)比较氧化性Cl2________MnO2(填>、<或=)
答案:
解析:
提示:
解析:
|
答案:(1)1 mol(2分) (2)Cl2;(1分) 1∶2(2分) (3)<(2分) 解析:依据反应化学方程式对氧化产物、氧化剂和还原剂做出判断,其中HCl部分被氧化.根据氧化剂的氧化性大于氧化产物的氧化性可作出最后一问的判断 |
提示:
|
本题一实验室制备氯气为载体,考查对氧化还原概念的理解和定量问题 |

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
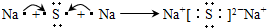
 2ClO2↑+K2SO4+2CO2↑+2H2O (H2C2O4俗称草酸,其中H为+1价,O为-2价)则下列说法正确的是______.
2ClO2↑+K2SO4+2CO2↑+2H2O (H2C2O4俗称草酸,其中H为+1价,O为-2价)则下列说法正确的是______.