题目内容
下列电离方程式书写有误的是( )
分析:强电解质在水中能完全电离,弱电解质在水中部分电离,离子团在电离时不能拆开.
解答:解:A、硫酸氢钠是强酸性的盐,在水中完全电离出三种离子,即NaHSO4═Na++H++SO42-,故A正确;
B、碳酸氢钠能完全电离,电离方程式为:NaHCO3═Na++HCO3-,故B正确;
C、醋酸是弱电解质,不能完全电离,电离方程式应写为:CH3COOH?H++CH3COO-,故C错误;
D、氢氧化钡是强碱,能完全电离,电离方程式为:Ba(OH)2═Ba2++2OH-,故D正确.
故选C.
B、碳酸氢钠能完全电离,电离方程式为:NaHCO3═Na++HCO3-,故B正确;
C、醋酸是弱电解质,不能完全电离,电离方程式应写为:CH3COOH?H++CH3COO-,故C错误;
D、氢氧化钡是强碱,能完全电离,电离方程式为:Ba(OH)2═Ba2++2OH-,故D正确.
故选C.
点评:本题考查学生电离方程式的书写方法,可以根据教材知识来回答,难度不大.

练习册系列答案
相关题目
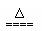 NH3↑+SO32- +2H2O?
NH3↑+SO32- +2H2O? Na2O2、HCl、Al2O3三种物质在水中完全反应后,溶液中只含有Na+、H+、Cl-、OH-,且溶液呈中性,则Na2O2、HCl、Al2O3的物质的量之比可能为 。
Na2O2、HCl、Al2O3三种物质在水中完全反应后,溶液中只含有Na+、H+、Cl-、OH-,且溶液呈中性,则Na2O2、HCl、Al2O3的物质的量之比可能为 。  NH3↑+SO32- +2H2O?
NH3↑+SO32- +2H2O?