题目内容
 如图是元素周期表中短周期的一部分,X、Y、Z、W四种元素的原子核外最外层电子数之和等于Y、Z元素的原子序数之和.下列说法不正确的是( )
如图是元素周期表中短周期的一部分,X、Y、Z、W四种元素的原子核外最外层电子数之和等于Y、Z元素的原子序数之和.下列说法不正确的是( )分析:X、Y、Z、W四种元素是短周期元素,设X的原子序数是a,则Y、Z、W的原子序数分别是(a+1)、(a+7)、(a+10),设X的最外层电子数是b,则Y、Z、W的最外层电子数分别是b+1、b-1、b+2,X属于第二周期元素,则a-b=2,X、Y、Z、W四种元素的原子核外最外层电子数之和等于Y、Z元素的原子序数之和,所以b+(b+1)+(b-1)+(b+2)=(a+1)+(a+7),联立方程解得a=7,b=5,所以X是N元素,Y是O元素,Z是Si元素,W是Cl元素.
解答:解:X、Y、Z、W四种元素是短周期元素,设X的原子序数是a,则Y、Z、W的原子序数分别是(a+1)、(a+7)、(a+10),设X的最外层电子数是b,则Y、Z、W的最外层电子数分别是b+1、b-1、b+2,X属于第二周期元素,则a-b=2,X、Y、Z、W四种元素的原子核外最外层电子数之和等于Y、Z元素的原子序数之和,所以b+(b+1)+(b-1)+(b+2)=(a+1)+(a+7),联立方程解得a=7,b=5,所以X是N元素,Y是O元素,Z是Si元素,W是Cl元素,
A.X元素形成的气态氢化物是氨气,氨气分子中含有3个σ键和一个孤电子对,所以氨气分子的空间结构是三角锥形,故A正确;
B.Z与Y元素形成的化合物是二氧化硅,属于原子晶体,熔点很高,故B正确;
C.氯气属于分子晶体,相对分子质量较大,分子间作用力较大,加压时氯气易液化,故C正确;
D.Z最高价氧化物是二氧化硅,不溶于硝酸,故D错误;
故选D.
A.X元素形成的气态氢化物是氨气,氨气分子中含有3个σ键和一个孤电子对,所以氨气分子的空间结构是三角锥形,故A正确;
B.Z与Y元素形成的化合物是二氧化硅,属于原子晶体,熔点很高,故B正确;
C.氯气属于分子晶体,相对分子质量较大,分子间作用力较大,加压时氯气易液化,故C正确;
D.Z最高价氧化物是二氧化硅,不溶于硝酸,故D错误;
故选D.
点评:本题考查了元素的推断、元素化合物性质、分子结构与性质等,正确推断元素是解本题关键,注意掌握原子序数的关系,难度中等.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
如图是元素周期表中短周期的一部分,若a原子最外层电子数比次外层少3,则下列说法正确的是( )
| d | ||
| a | b | c |
| A、a、b、c的最高价氧化物对应水化化物的酸性强弱关系是c>b>a |
| B、d的氢化物没有b的氢化物稳定 |
| C、原子半径的大小关系c>b>a |
| D、单质的氧化性关系:a>b |
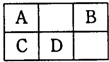 (2011?郑州二模)如图是元素周期表中短周期元素的一部分,A、D两元素原子核内质子数之和为23.下列有关说法中,不正确的是( )
(2011?郑州二模)如图是元素周期表中短周期元素的一部分,A、D两元素原子核内质子数之和为23.下列有关说法中,不正确的是( )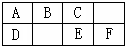 如图是元素周期表中短周期的一部分,B、C、D、F四种元素的原子核外最外层电子数之和等于C、D元素的原子序数之和.下列说法不正确的是( )
如图是元素周期表中短周期的一部分,B、C、D、F四种元素的原子核外最外层电子数之和等于C、D元素的原子序数之和.下列说法不正确的是( )