题目内容
对某酸性溶液(可能含有Br-、SO
、H2SO3、NH
分别进行如下实验:①加热时放出的气体可以使品红溶液褪色;②加碱调至碱性后,加热时放出的气体可以使湿润的红色石蕊试纸变蓝;③加入氯水时,溶液略显黄色,再加入BaCl2溶液时,产生的白色沉淀不溶于稀硝酸.对于下列物质不能确认其在溶液中是否存在的是( )
2- 4 |
+ 4 |
分析:酸性溶液中可能含有Br-、SO
、H2SO3、NH
离子;
①加热时放出的气体可以使品红溶液褪色,证明生成二氧化硫气体证明含有H2SO3;
②加碱调至碱性后,加热时放出的气体可以使湿润的红色石蕊试纸变蓝,证明是氨气,原溶液中含有NH4+;
③加入氯水时,溶液略显黄色,说明是氯气氧化溴离子为溴单质,再加入BaCl2溶液时,产生的白色沉淀不溶于稀硝酸是硫酸钡沉淀,但加入氯水会把亚硫酸氧化为硫酸.
2- 4 |
+ 4 |
①加热时放出的气体可以使品红溶液褪色,证明生成二氧化硫气体证明含有H2SO3;
②加碱调至碱性后,加热时放出的气体可以使湿润的红色石蕊试纸变蓝,证明是氨气,原溶液中含有NH4+;
③加入氯水时,溶液略显黄色,说明是氯气氧化溴离子为溴单质,再加入BaCl2溶液时,产生的白色沉淀不溶于稀硝酸是硫酸钡沉淀,但加入氯水会把亚硫酸氧化为硫酸.
解答:解:①加热时放出的气体可以使品红褪色,则溶液中一定含有H2SO3,因H2SO3不稳定,分解产生的SO2可使品红褪色;
②加碱后加热,产生使润湿的红色石蕊试纸变蓝的气体,即有NH3产生,说明溶液中一定含有NH
;
③加氯水时溶液显黄色,说明原溶液中含有Br-;再加BaCl2有白色不溶于HNO3的沉淀生成,说明此时溶液中含SO
,但可能是原溶液含有的,也可能是氯水氧化H2SO3产生的,故不能确定的为SO
;
故选B.
②加碱后加热,产生使润湿的红色石蕊试纸变蓝的气体,即有NH3产生,说明溶液中一定含有NH
+ 4 |
③加氯水时溶液显黄色,说明原溶液中含有Br-;再加BaCl2有白色不溶于HNO3的沉淀生成,说明此时溶液中含SO
2- 4 |
2- 4 |
故选B.
点评:本题考查了离子性质的分析,离子检验的实验方法和反应现象判断,掌握离子性质是解题关键题目难度中等.

练习册系列答案
 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
某化学兴趣小组在实验室对某固体催化剂(可能含有FeO、Fe2O3中的一种或两种)中铁元素的价态进行探究(已知:Fe2+能使高锰酸钾的酸性溶液褪色,反应式为:5 Fe2++MnO4—+8H+==5Fe3++Mn2++4H2O)。
(1)将该固体催化剂在稀硫酸中溶解,请写出这两种氧化物与稀硫酸反应的离子方程式:
、 。
(2)请完成对铁元素价态的探究:
限选实验仪器与试剂:烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹;
3 mol·L-1H2SO4,3% H2O2、6 mol·L-1HNO3、饱和氯水、0.01 mol·L-1KmnO4、0.1 mol·L-1KI、20% KSCN溶液、蒸馏水。
①提出合理假设
假设1: ;
假设2: ;
假设3:催化剂中铁元素的价态既有+3价又有+2价。
①设计实验方案证明你的假设(不要在答题卡上作答)
②实验过程
根据②的实验方案,进行实验。请在答题卡上按下表格式写出实验操作步骤、预期现象与结论。
| 实验操作 | 预期现象与结论 |
| 步骤1:将适量稀H2SO4加入少许样品于试管中,加热溶解;然后将所得溶液分置 于A、B试管中。 | 溶液呈黄绿色,说明溶液中含Fe2+或Fe3+。 |
| 步骤2: | |
| 步骤3: | |
| … |
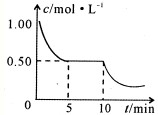
 学校化学研究小组对某溶液进行检测分析,该无色溶液中可能含有NH4+、K+、Al3+、HCO3-、Cl-、MnO4-、SO42-等离子中的几种离子.
学校化学研究小组对某溶液进行检测分析,该无色溶液中可能含有NH4+、K+、Al3+、HCO3-、Cl-、MnO4-、SO42-等离子中的几种离子.
 (2012?浙江模拟)学校化学研究小组对某溶液进行检测分析,该无色溶液中可能含有NH4+、K+、Al3+、HCO3-、Cl-、MnO4-、SO42-等离子中的几种离子.
(2012?浙江模拟)学校化学研究小组对某溶液进行检测分析,该无色溶液中可能含有NH4+、K+、Al3+、HCO3-、Cl-、MnO4-、SO42-等离子中的几种离子.