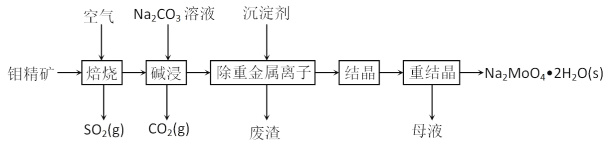
��Ŀ����
����Ŀ��һ���¶�����ij�����м���������̼�����������ӦCaCO3(s)![]() CaO(s)+CO2(g)���ﵽƽ��������˵����ȷ����
CaO(s)+CO2(g)���ﵽƽ��������˵����ȷ����
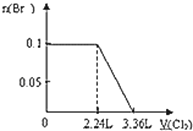
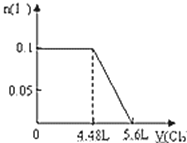
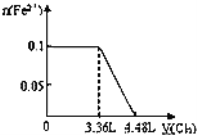
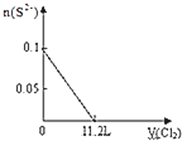
A���������СΪԭ����һ�룬����ϵ�ٴδﵽƽ��ʱ��CO2��Ũ��Ϊԭ����2��
B��CaCO3(s)���ȷֽ�����CaO(s)��CO2(g)����S<0
C�����������Ϊԭ����2�����ٴδﵽƽ��ʱ��������ܶȱ�С
D����������������䣬����He��ƽ�����淴Ӧ�������
���𰸡�C
��������
���������A���������С��ԭ����һ�룬��ѹǿ����ƽ�������ƶ���������̼��Ũ�ȱ�ԭ����2��Ũ��С������ѡA��B�������ʵ�״̬��������ӦΪ����������ѡB��C�����������Ϊԭ����2��������ѹ��ƽ�������ƶ���������̼��Ũ�ȱ�ԭ��С���ܶȱ�С����ȷ��ѡC��D������������������䣬���뺤���������Ũ�Ȳ��䣬ƽ�ⲻ�ƶ�������ѡD��

 ����ѵ�����⿼ϵ�д�
����ѵ�����⿼ϵ�д�����Ŀ���ҹ�����ר�Һ�°�ġ������Ƽ����Ϊ�����Ƽҵ������ͻ�����ף����Ա���ʳ��ˮ��NH3��CO2Ϊԭ�����Ƶ�NaHCO3����������������ش��������⣺
ij̽���С����������Ƽ�ԭ��������̼�����Ƶ��Ʊ�ʵ�飬ͬѧ�ǰ�������Ʒ���ʵ�顣һλͬѧ��������̼����ͨ�뺬���ı���ʳ��ˮ���Ʊ�̼�����ƣ�ʵ��װ����ͼ��ʾ(ͼ�мг֡��̶��õ�����δ����)
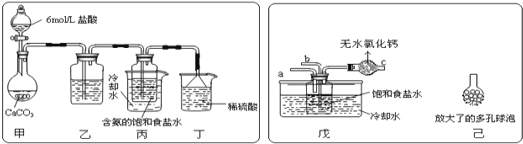
��1����װ����ϡ�����������____��
��2����һλͬѧ��ͼ����װ�ã�����װ��δ����������ʵ�顣ʵ��ʱ�����ȴ�___��ͨ��NH3���塣
��3����ͬѧ��������װ�õ�b���¶����Ӽ�װ�ã�������_____��
��4����������г�������������ڲ�ͬ�¶��µ��ܽ�����ݣ�g/100gˮ����
0�� | 10�� | 20�� | 30�� | 40�� | 50�� | |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
���ձ������ݣ������������װ����ʹ����ȴˮ���߱�ˮ��ԭ��____��
��5����С��ͬѧΪ�˲ⶨ�������þ����̼�����ƵĴ��ȣ����辧���в���̼�������ʣ����������ָ����������Ϊag���ٽ�������ȵ��������ٱ仯ʱ���������÷�ĩ����Ϊmg��Ȼ�������ͼ��ʾʵ�飺
![]()
���ڲ������У�Ϊ���жϼ����Ȼ�����Һ�Ƿ������������ȷ����___������ĸ����
a �ڼ����Ȼ�����Һ�������ã�����Һ�м������������Ȼ�����Һ
b �ڼ����Ȼ�����Һ�������ã�����Һ���ټ�������̼������Һ
c �ڼ����Ȼ�����Һ�������ã�ȡ�ϲ���Һ�ټ�������̼������Һ
�����þ�����̼�����ƵĴ���Ϊ___��
����Ŀ��Ϊ��ǿ������ʴ�ԣ�����Ǧ����Ϊ���Դ����Al��������Pb�����������ϡ���ᣬʹ�����������Ĥ�����䷴Ӧԭ�����£� ��أ� Pb(s) + PbO2(s) + 2H2SO4(aq) =2PbSO4(s) + 2H2O(l)��
���أ�2Al+3O2![]() Al2O3+3H2���������У������ж���ȷ���ǣ� ��
Al2O3+3H2���������У������ж���ȷ���ǣ� ��
��� | ���� | |
A | H+����Pb�缫 | H+����Pb�缫 |
B | ÿ����3molPb | ����2molAl2O3 |
C | ������PbO2+4H++2e��=Pb2++2H2O | ������2Al+3H2O-6e��=Al2O3+6H+ |
D |
|
|