题目内容
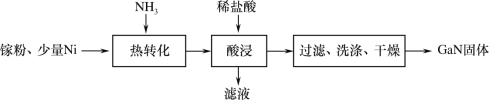
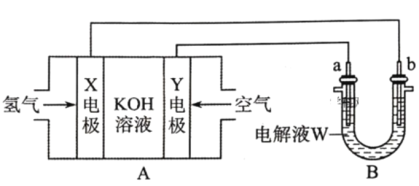
【题目】电化学原理在化学工业中有广泛的应用。根据如下工作原理图,下列说法正确的是
A.电极Y为正极,电极反应式为: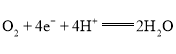
B.若W为饱和食盐水(滴有几滴酚酞溶液),则工作一段时间后a电极附近溶液变红
C.若a为粗铜(含Zn、Ag等杂质),W为CuSO4溶液,工作一段时间后![]() 减小
减小
D.若a为银棒,b为铜棒,W为AgNO3溶液,工作一段时间后发现铜棒增重2.16g,则X电极消耗氢气0.224L
【答案】C
【解析】
由图可知,A装置为碱性氢氧燃料电池,X电极为负极,发生的电极反应式为:H2+2OH--2e-=2H2O,Y电极为正极,发生的电极反应式为:O2+2H2O+4e-=4OH-,总反应为:2H2+O2=2H2O;B装置为电解池,a为阳极,b为阴极,据此分析解答。
A.由分析可知,电极Y为正极,电极反应式为:O2+2H2O+4e-=4OH-,A错误;
B.a极为阳极,若W为饱和食盐水,有两种情况:若a极为活性电极如Cu,则a电极失电子变为相应的阳离子如Cu2+,若a为惰性电极,则电极反应式为:2Cl--2e-=Cl2↑,a极附近不显碱性,溶液不变红,B错误;
C.a为阳极,若a为粗铜(含Zn、Ag等杂质),则a极为Zn和Cu失电子变为Zn2+和Cu2+,b为阴极,Cu2+得电子变为Cu,根据得失电子守恒可知,a极补充的Cu2+小于b极消耗的Cu2+,即工作一段时间后,溶液中Cu2+浓度会减小,C正确;
D.没有给标准状况,无法计算X电极消耗氢气的体积,D错误;
答案选C。

【题目】一定温度下,体积为2 L的密闭容器中X、Y、Z三种气体的初始物质的量和平衡物质的量如下表:
物质 | X | Y | Z |
初始物质的量/mol | 0.2 | 0.2 | 0 |
平衡物质的量/mol | 0.1 | 0.05 | 0.1 |
下列说法正确的是( )
A.反应可表示为![]() ,其平衡常数为8 000
,其平衡常数为8 000
B.增大压强使平衡向生成Z的方向移动,则平衡常数增大
C.若将容器的体积压缩至1 L,则X的体积分数减小,浓度增大
D.若升高温度,Z的浓度增大,则温度升高时![]() 正增大,
正增大,![]() 逆减小
逆减小