题目内容
铅蓄电池在日常生活中有着广泛的应用,它的电池反应为Pb+PbO2+2H2SO4
2PbSO4+2H2O,下列说法正确的是( )
| 充电 |
| 放电 |
分析:在充电时,该装置是电解池,阳极上硫酸铅失电子发生氧化反应,阴极上硫酸铅得电子发生还原反应,导致溶液中硫酸浓度增大;
放电时,该装置是原电池,负极上铅失电子发生氧化反应,正极上二氧化铅得电子发生还原反应,硫酸参加反应,导致硫酸浓度降低.
放电时,该装置是原电池,负极上铅失电子发生氧化反应,正极上二氧化铅得电子发生还原反应,硫酸参加反应,导致硫酸浓度降低.
解答:解:A.正极上二氧化铅得电子发生还原反应,电极反应式为PbO2+4H++SO42-+2e-=PbSO4(s)+2H2O,故A错误;
B.放电时阴离子向负极移动,故B错误;
C.随着放电的进行,硫酸参加反应,导致硫酸浓度降低,故C正确;
D.充电时,阳极上失电子发生氧化反应,故D错误;
故选C.
B.放电时阴离子向负极移动,故B错误;
C.随着放电的进行,硫酸参加反应,导致硫酸浓度降低,故C正确;
D.充电时,阳极上失电子发生氧化反应,故D错误;
故选C.
点评:本题考查了原电池和电解池原理,难点是电极反应式的书写,根据得失电子结合电解质溶液写电极反应式.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
人们应用原电池原理制作了多种电池,以满足不同的需要。以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格。
(1)蓄电池在放电时起原电池作用,在充电时起电解池的作用。铅蓄电池在放电时发生的电池反应式为:Pb+PbO2+2H2SO4=2PbSO4+2H2O。
负极反应式为 。
正极反应式为 。
(2)铁、铜、铝是生活中使用广泛的金属,FeCl3溶液常用于腐蚀印刷电路铜板,其反应过程的离子方程式为 ,若将此反应设计成原电池,则负极所用电极材料为 ,正极反应式为 。
(3)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为 。
| A.铝片、铜片 | B.铜片、铝片 | C.铝片、铝片 | D.铜片、铜片 |
(4)燃料电池是一种高效、环境友好的供电装置,如图是甲烷燃料电池原理示意图,回答下列问题:
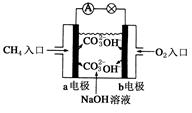
①电池的负极是__________(填“a”或“b”),该极的电极反应式是:________________。
②电池工作一段时间后电解质溶液的pH_________(填“增大”、“减小”或“不变”)。