题目内容
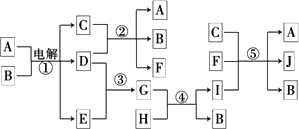
如下图所示物质间的相互转变关系,反应①在工业上可用来生产化合物C,反应⑤在工业上可生产化合物J(Na2FeO4),反应①、②、④和⑤均是在水溶液中进行的反应.常温下D、E、G均是气体,B是无色液体;F的水溶液可作为杀菌消毒剂;H是一种铁矿石的主要成分,它由两种元素组成,且其中铁元素的质量分数为70%.
请回答下列问题:
(1)写出F的化学式:________.
(2)人们将反应①涉及的化学工业称为________.
(3)写出B与D反应的离子方程式________.
(4)写出反应④的离子方程式________.
(5)写出反应⑤的离子方程式________.
(6)高铁酸钠(Na2FeO4)被人们认为是一种“绿色环保高效”的净水剂,其原因为:①Na2FeO4具有强氧化性可杀菌消毒;②________
解析:
|
(1)NaClO(1分) (2)氯碱工业(1分) (3)Cl2+H2O (4)Fe2O3+6H+ (5)2Fe3++3ClO-+10OH- (6)Na2FeO4被还原为Fe3+、Fe3+水解生成Fe(OH)3胶体能吸附水中的悬浮物和杂质形成沉淀,使水澄清(2分) |

 通城学典默写能手系列答案
通城学典默写能手系列答案(12分)在不同温度下,反应CO2(g)+H2(g) CO(g)+H2O(g)的平衡常数K如下表:
CO(g)+H2O(g)的平衡常数K如下表:
| 温度/℃ | 700 | 800 | 850 | 1000 | 1200 |
| 平衡常数K | 2.6 | 1.7 | 1 | 0.9 | 0.6 |
(2)850℃时发生上述反应,CO2的转化率随时间变化如图所示。其他条件相同时,请在下图中画出700℃时CO2的转化率随时间变化的示意图(注明必要的标示)。

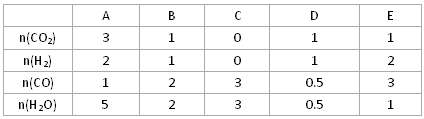
(3)在850℃时发生上述反应,以下表中的物质的量投入恒容反应器,其中向正方向移动的组是 (填代号),平衡后与C中各物质的百分含量相等的组有__________(填代号 )
| | A | B | C | D | E |
| n(CO2)[ | 3 | 1 | 0 | 1 | 1 |
| n(H2) | 2 | 1 | 0 | 1 | 2 |
| n(CO) | 1 | 2 | 3 | 0.5 | 3 |
| n(H2O) | 5 | 2 | 3 | 0.5 | 1 |
(12分)在不同温度下,反应CO2(g)+H2(g) CO(g)+H2O(g)的平衡常数K如下表:
CO(g)+H2O(g)的平衡常数K如下表:
|
温度/℃ |
700 |
800 |
850 |
1000 |
1200 |
|
平衡常数K |
2.6 |
1.7 |
1 |
0.9 |
0.6 |
(1)该反应的△H 0。(填“>”、“=”或“<”)。若到达平衡后升高温度,则CO2的转化率将 ,正反应速率 (填“增大”、“减小”或“不变”)。
(2)850℃时发生上述反应,CO2的转化率随时间变化如图所示。其他条件相同时,请在下图中画出700℃时CO2的转化率随时间变化的示意图(注明必要的标示)。

(3)在850℃时发生上述反应,以下表中的物质的量投入恒容反应器,其中向正方向移动的组是 (填代号),平衡后与C中各物质的百分含量相等的组有__________(填代号 )
|
|
A |
B |
C |
D |
E |
|
n(CO2)[ |
3 |
1 |
0 |
1 |
1 |
|
n(H2) |
2 |
1 |
0 |
1 |
2 |
|
n(CO) |
1 |
2 |
3 |
0.5 |
3 |
|
n(H2O) |
5 |
2 |
3 |
0.5 |
1 |
(4) 850℃时,在1L的密闭容器中分别充入2mol的CO2和H2,计算反应到达平衡时CO的物质的量浓度。(写出计算过程)

 CO(g)+H2O(g)的平衡常数K如下表:
CO(g)+H2O(g)的平衡常数K如下表:

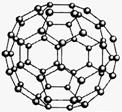 C60(结构模型如下图所示)的发现是化学界的大事之一。C60与金属钾化合生成K3C60。K3C60具有超导性。k.s.5.u
C60(结构模型如下图所示)的发现是化学界的大事之一。C60与金属钾化合生成K3C60。K3C60具有超导性。k.s.5.u