题目内容
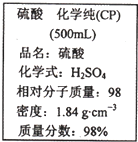
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此回答下列问题:
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此回答下列问题:(1)该硫酸的物质的量浓度为
18.4
18.4
mol/L.(2)配制250mL 0.92mol?L-1的稀硫酸需取该硫酸
12.5
12.5
mL.(3)配制时必需的玻璃仪器有:
玻璃棒、烧杯、量筒、胶头滴管、250mL容量瓶
玻璃棒、烧杯、量筒、胶头滴管、250mL容量瓶
(4)定容时,待容量瓶中溶液的凹液面正好与刻度线相切,盖好瓶塞后的下一步操作是
倒转反复摇匀
倒转反复摇匀
.(5)定容时,若加入的水超过刻度线,必须采取的措施是
重新配制
重新配制
(6)下列操作对H2SO4的物质的量浓度有什么影响(偏高、偏低或无影响)?
①转移溶液后,未洗涤烧杯:
偏低
偏低
;②容量瓶用水洗净后未烘干:无影响
无影响
;③定容时俯视容量瓶的刻度线:偏高
偏高
.分析:(1)根据c=
计算该硫酸的物质的量浓度;
(2)根据稀释定律c1V1=c2V2计算需要浓硫酸的体积;
(3)用浓硫酸配制稀硫酸溶液需要的仪器有:玻璃棒、烧杯、量筒、胶头滴管、250mL容量瓶;
(4)溶液配制,盖好瓶塞后,需要倒转反复摇匀;
(5)定容时,若加入的水超过刻度线,导致所配溶液浓度偏低,需要重新配制;
(6)分析操作对溶质物质的量、溶液体积的影响,根据c=
判断对所配溶液浓度影响.
| 1000ρw |
| M |
(2)根据稀释定律c1V1=c2V2计算需要浓硫酸的体积;
(3)用浓硫酸配制稀硫酸溶液需要的仪器有:玻璃棒、烧杯、量筒、胶头滴管、250mL容量瓶;
(4)溶液配制,盖好瓶塞后,需要倒转反复摇匀;
(5)定容时,若加入的水超过刻度线,导致所配溶液浓度偏低,需要重新配制;
(6)分析操作对溶质物质的量、溶液体积的影响,根据c=
| n |
| V |
解答:解:(1)密度为1.84g/mL、质量分数为98%的硫酸,其物质的量浓度=
mol/L=18.4mol/L,故答案为:18.4mol/L;
(2)设配制250mL 0.92mol?L-1的稀硫酸需取浓硫酸的体积为V mL,根据稀释定律,则:
250mL×0.92mol/L=V mL×18.4 mol/L,解得V=12.5,
故答案为:12.5;
(3)用浓硫酸配制稀硫酸溶液需要的仪器有:玻璃棒、烧杯、量筒、胶头滴管、250mL容量瓶,
故答案为:玻璃棒、烧杯、量筒、胶头滴管、250mL容量瓶;
(4)溶液配制,盖好瓶塞后,需要倒转反复摇匀,故答案为:倒转反复摇匀;
(5)定容时,若加入的水超过刻度线,导致所配溶液浓度判断,需要重新配制,故答案为:重新配制;
(6)①转移溶液后,未洗涤烧杯,移入容量瓶内硫酸物质的量减小,所配溶液浓度偏低;
②溶液配制需加水定容,容量瓶用水洗净后未烘干对所配溶液浓度无影响;
③定容时俯视容量瓶的刻度线,液面在刻度线下方,溶液体积偏小,所配溶液浓度偏高,
故答案为:偏低;无影响;偏高.
| 1000×1.84×98% |
| 98 |
(2)设配制250mL 0.92mol?L-1的稀硫酸需取浓硫酸的体积为V mL,根据稀释定律,则:
250mL×0.92mol/L=V mL×18.4 mol/L,解得V=12.5,
故答案为:12.5;
(3)用浓硫酸配制稀硫酸溶液需要的仪器有:玻璃棒、烧杯、量筒、胶头滴管、250mL容量瓶,
故答案为:玻璃棒、烧杯、量筒、胶头滴管、250mL容量瓶;
(4)溶液配制,盖好瓶塞后,需要倒转反复摇匀,故答案为:倒转反复摇匀;
(5)定容时,若加入的水超过刻度线,导致所配溶液浓度判断,需要重新配制,故答案为:重新配制;
(6)①转移溶液后,未洗涤烧杯,移入容量瓶内硫酸物质的量减小,所配溶液浓度偏低;
②溶液配制需加水定容,容量瓶用水洗净后未烘干对所配溶液浓度无影响;
③定容时俯视容量瓶的刻度线,液面在刻度线下方,溶液体积偏小,所配溶液浓度偏高,
故答案为:偏低;无影响;偏高.
点评:本题考查一定物质的量浓度溶液配制,难度中等,注意根据c=
理解溶液配制原理与误差分析.
| n |
| V |

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法错误的是( )
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法错误的是( )| A、该硫酸具有强烈的腐蚀性,应放于危险化学用品柜中妥善保管 | B、取10 mL该硫酸于烧杯中,再加等体积的水,可配得49%的硫酸 | C、配制200mL4.6 mol?L-1的稀硫酸需取该硫酸50mL | D、该硫酸与等质量的水混合所得溶液的物质的量浓度小于9.2 mol?L-1 |
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此,下列说法正确的是( )
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此,下列说法正确的是( )
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法不正确的是( )
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法不正确的是( ) 如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制100mL 1mol?L-1的稀硫酸.
如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制100mL 1mol?L-1的稀硫酸.