题目内容
【题目】某小组同学为探究物质的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
已知:①溴水为溴的水溶液,溴水为橙黄色,溴蒸气为红棕色,均有毒
②氯水为氯气的水溶液。
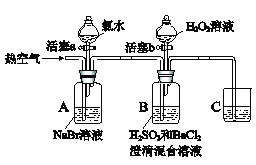
实验记录如下:
实验操作 | 实验现象 | |
Ⅰ | 打开活塞a,滴加氯水,关闭活塞a | A中溶液变为橙黄色 |
Ⅱ | 吹入热空气 | A中橙黄色明显变浅;B中有气泡,产生大量白色沉淀,混合液颜色无明显变化 |
Ⅲ | 停止吹入空气,打开活塞b,逐滴加入H2O2溶液 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成橙黄色 |
请回答下列问题:
(1)A中反应的离子方程式是__________________________________________。
(2)实验操作II吹入热空气的目的是___________________________________。
(3)装置C的作用是_____________________________________。
(4)实验操作III,混合液逐渐变成橙黄色,其对应的离子方程式是____________。
(5)由操作I得出的结论是_____________,由操作III得出的结论是______________。
(6)实验反思:实验操作III,开始时颜色无明显变化的原因是(写出一条即可):___________。
【答案】 2Br﹣+Cl2=Br2+2Cl﹣ 吹出单质Br2 吸收Br2,防止污染空气 H2O2+2Br﹣+2H+=Br2+2H2O Cl2的氧化性强于Br2 H2O2的氧化性强于Br2 H2SO3有剩余(H2O2的浓度小或Br-与H2O2反应慢等因素都可)
【解析】实验分析:本实验利用“氧化剂氧化性大于氧化产物;强氧化性制弱氧化性”的原理探究物质氧化性的强弱。第I步,向A中(NaBr溶液)滴加氯水,A中溶液变橙黄色,则有Br2单质产生,Cl2将Br-氧化为Br2,证明Cl2氧化性强于Br2。第Ⅱ步,向A中吹入热空气,溴易挥发,A中橙黄色变浅,则Br2被热空气赶入装置B中(H2SO3和BaCl2的混合溶液);B中有气泡,产生大量白色沉淀,该沉淀应为BaSO4,则SO42-产生;混合液颜色无明显变化,则Br2自身被还原为Br-,说明Br2氧化性强于SO42-。第Ⅲ步,停止吹入空气,向装置B中逐滴加入H2O2溶液,一段时间后,混合液逐渐变成橙黄色,则Br-又被氧化为Br2,说明H2O2氧化性强于Br2。
(1)根据上述分析,A中发生的反应为氯水将NaBr氧化为Br2,溶液变橙黄色,离子方程式为:2Br﹣+Cl2=Br2+2Cl﹣;故答案为:2Br﹣+Cl2=Br2+2Cl﹣;
(2)根据上述分析,吹入热空气,是利用溴的挥发性,将溴单质被赶入B中。
故答案为:吹出单质Br2;
(3)反应过程中有溴蒸气等污染性气体不能排放到空气中需要用NaOH溶液吸收,故C装置应是盛装NaOH溶液,用来吸收尾气。答案为:吸收Br2,防止污染空气;
(4)滴加H2O2溶液,一段时间后,混合液逐渐变成橙黄色,说明H2O2在酸溶液中将Br﹣氧化为Br2,离子方程式为:H2O2+2Br﹣+2H+=Br2+2H2O。故答案为:H2O2+2Br﹣+2H+=Br2+2H2O;
(5)根据实验分析,操作I证明Cl2的氧化性强于Br2;操作Ⅲ证明H2O2的氧化性强于Br2。
故答案为:Cl2的氧化性强于Br2;H2O2的氧化性强于Br2;
(6)实验操作III,开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成橙黄色。开始时颜色无明显变化的可能原因是,H2O2与Br﹣反应慢;也可能是溶液中原本有H2SO3有剩余,加入H2O2,H2O2先和H2SO3反应。
故答案为:H2SO3有剩余(H2O2的浓度小或Br-与H2O2反应慢等因素都可)

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】将一定量纯净的 X 置于某 10L 容积恒定的真空容器中(假设固体试样体积忽略不计),在恒定温度下使其达到分解平衡:X(s)2Y(g)+Z(g),实验测得不同温度下的分解平衡常数列于如表,下列说法中不正确的是( )
温度( | 15.0 | 25.0 | 30.0 | 35.0 |
K/(×10﹣8 mol3L﹣3) | 0.205 | 1.64 | 4.68 | 10.8 |
A.若Z的体积分数不再随时间变化时表示反应达平衡状态
B.35 ![]() 时,达平衡时,X分解了 0.03 mol
时,达平衡时,X分解了 0.03 mol
C.该反应在高温下可能自发
D.若在恒温下,压缩容器体积,再次达平衡后,n(X)比原平衡大