题目内容
【题目】某化学课外小组利用图1装置探究SO2的性质.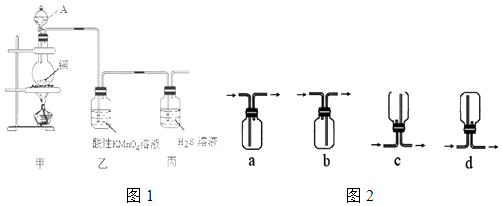
请回答下列问题:
(1)装置甲中A仪器的名称是 .
(2)装置乙中出现的现象是 , 可以证明SO2具有(填代号).装置丙中发生反应的化学方程式为 , 可以证明SO2具有(填代号).
a.氧化性 b.还原性 c.漂自性
(3)收集SO2气体可以选择的装置如图2为(填代号).从环保的角度考虑,收集装置的出气口需要连接一个盛有(填化学式)溶液的洗气瓶.
【答案】
(1)分液漏斗
(2)溶液褪色,b,2H2S+SO2=3S↓+2H2O,a
(3)ac,NaOH
【解析】解:(1)根据仪器的特点知道仪器A的名称是分液漏斗,所以答案是:分液漏斗;
(2)高锰酸钾具有强氧化性,二氧化硫具有还原性,能使高锰酸钾溶液褪色,能和氢硫酸之间反应得到单质硫,反应为2H2S+SO2=3S↓+2H2O,体现二氧化硫的氧化性,
所以答案是:溶液褪色;b;2H2S+SO2=3S↓+2H2O;a;
(3)二氧化硫的密度大于空气,就可选择向上排空气法,收集收集SO2气体可以选择的装置为ac,二氧化硫具有毒性,要进行尾气处理,可以用氢氧化钠来吸收,
所以答案是:ac;NaOH.

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案【题目】江水受到污染,其污染的主要原因是 ( )
①工业生产中废液的任意排放 ②雨水和土壤的长期接触 ③农业生产中农药、化肥的过量施用 ④城市生活污水的任意排放
A.①②③
B.②③④
C.①③④
D.①②③④
【题目】1000mL某待测液中除含有0.2molL﹣1的Na+外,还可能含有下列离子中的一种或多种:
阳离子 | K+、NH4+、Fe3+、Ba2+ |
阴离子 | Cl﹣、Br﹣、CO32﹣、HCO3﹣、SO32﹣、SO42﹣ |
现进行如下实验操作(每次实验所加试剂均过量): 
(1)写出生成白色沉淀B的离子方程式: .
(2)待测液中肯定不存在的阳离子是 .
(3)若无色气体D是单一气体:
阴离子 | Cl﹣ | Br﹣ | CO32﹣ | HCO3﹣ | SO32﹣ | SO42﹣ |
浓度/molL﹣1 |
①将阴离子的物质的量浓度填入下表中(一定不存在的填“0”,不能确定的填“?”):
②判断原溶液中K+是否存在,若存在,求其物质的量浓度的最小值,若不存在,请说明理由: .
(4)若无色气体D是混合气体: ①待测液中一定含有的阴离子是 .
②沉淀A中能与稀硝酸反应的成分是(写化学式).