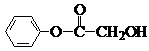题目内容
在CH3COONa溶液中各离子的浓度由大到小排列顺序正确的是( )
分析:CH3COONa为强碱弱酸盐,溶液呈碱性,一般来说,单水解程度较小,以此比较溶液离子浓度的大小.
解答:解:CH3COONa为强碱弱酸盐,溶液呈碱性,则c(OH-)>c(H+),溶液存在电荷守恒,则c(CH3COO-)+c(OH-)=c(H+)+c(Na+),因此c(Na+)>c(CH3COO-),
因单水解的程度一般较弱,则有c(CH3COO-)>c(OH-),因此有c(Na+)>c(CH3COO-)>c(OH-)>c(H+),
故选A.
因单水解的程度一般较弱,则有c(CH3COO-)>c(OH-),因此有c(Na+)>c(CH3COO-)>c(OH-)>c(H+),
故选A.
点评:本体考查离子浓度的大小比较,题目难度不大,注意把握盐类水解的原理和弱电解质的电离特点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列说法正确的是( )
| A、100℃时,KW=10-12,此温度下PH=6的溶液一定显酸性 | B、25℃时,0.1mol/L的NaHSO3溶液pH=4,说明HSO3-在水溶液中只存在电离 | C、NH4Cl、CH3COONa、NaHCO3、NaHSO4溶于水,对水的电离都有促进作用 | D、25℃时,10mL 0.1mol/L CH3COOH溶液与5mL 0.1mol/L NaOH溶液混合,所得溶液中有2c(Na+)═c(CH3COO-)+c(CH3COOH) |