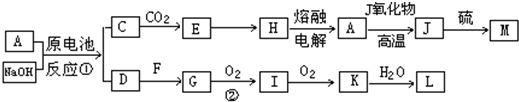
题目内容
某氨水PH=x,某盐酸PH=y,已知x+y=14,且x>11。将上述氨水、盐酸等体积混合后,所得溶液中各种离子浓度由大到小的顺序是 ( )
A.C(NH4+)>C(Cl-)>C(OH-)>C(H+)
B.C(Cl-)>C(NH4+)>C(H+)>C(OH-)
C.C(Cl-)=C(NH4+)>C(OH-)=C(H+)
D.C(Cl-)=C(NH4+)>C(OH-)>C(H+)
【答案】
A
【解析】
试题分析:氨水是弱碱,则根据题意可知,氨水的浓度应该大于盐酸的浓度,所以在等体积混合的情况下,氨水是过量的,溶液显碱性,所以溶液中离子浓度的大小关系是c(NH4+)>c(Cl-)>c(OH-)>c(H+),答案选A。
考点:考查溶液中离子浓度的大小比较
点评:该题是中等难度的试题,也是高考中的常见考点和题型。试题贴近高考,基础性强,侧重能力的培养和解题方法的指导。该题的关键是准确判断出酸碱的过量问题,然后在结合电荷守恒灵活分析、判断即可。

练习册系列答案
相关题目

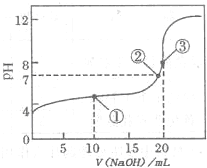 (2011?巢湖二模)滴定法是化学定量分析的一种重要而普遍的方法.
(2011?巢湖二模)滴定法是化学定量分析的一种重要而普遍的方法.