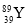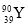ћвƒњƒЏ»Ё
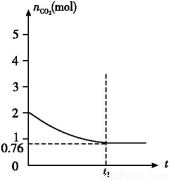
“їґ®ќ¬ґ»ѕ¬2 LµƒЇг»Ё»Ё∆чЉ„÷–,Љ”»л2 molћЉЇЌ2 mol CO2ЈҐ…ъ»зѕ¬Јі”¶: C(s)+CO2(g)  2CO(g)°°¶§H>0,≤вµ√»Ё∆ч÷–CO2µƒќп÷ µƒЅњЋж ±Љдtµƒ±дїѓєЎѕµ»зЌЉЋщ Њ°£
2CO(g)°°¶§H>0,≤вµ√»Ё∆ч÷–CO2µƒќп÷ µƒЅњЋж ±Љдtµƒ±дїѓєЎѕµ»зЌЉЋщ Њ°£
(1)Є√Јі”¶µƒ¶§S°°°°0(ћо°∞>°±°Ґ°∞<°±їт°∞=°±)°£‘Џ°°°°°°°°(ћо°∞љѕЄя°±їт°∞љѕµЌ°±)ќ¬ґ»ѕ¬”–јы”ЏЄ√Јі”¶„‘ЈҐљш––°£
(2)Ѕ– љ≤ҐЉ∆Ћг…ѕ цќ¬ґ»ѕ¬іЋЈі”¶µƒ∆љЇв≥£ э°°°°°°°°°°°°°°°°°°°°°° (љбєы±£Ѕф“їќї–° э)°£
(3)ѕт…ѕ ц∆љЇвћеѕµ÷–‘ўЌ®»лCO2,‘тCO2µƒ„™їѓ¬ °°°°°°°°(ћо°∞‘ціу°±°Ґ°∞Љх–°°±°Ґ°∞≤ї±д°±їт°∞ќёЈ®»Јґ®°±)°£
(4)ѕаЌђќ¬ґ»ѕ¬,2 LµƒЇг»Ё»Ё∆ч““÷–Љ”»л4 molћЉЇЌ4 mol CO2,іпµљ∆љЇв°£«л‘ЏЌЉ÷–ї≠≥ц““»Ё∆ч÷–CO2µƒќп÷ µƒЅњЋж ±Љдt±дїѓєЎѕµµƒ‘§∆Џљбєы Њ“вЌЉ°£(„Ґ√ч∆љЇв ±CO2µƒќп÷ µƒЅњ)
(5)ѕаЌђќ¬ґ»ѕ¬,2 LµƒЇг»Ё»Ё∆ч±ы÷–Љ”»л4 molћЉ°Ґ4 mol CO2ЇЌ4 mol CO°£њ™ ЉЈі”¶ ±v’э°°°°°°°° vƒж(ћо°∞>°±°Ґ°∞<°±їт°∞=°±)°£
(1)>°°љѕЄя°°
(2)K=c2(CO)/c(CO2)=1.242/0.38°÷4.0
(3)Љх–°
(4)

(5)>
°Њљвќц°њ(1)ЄщЊЁЈљ≥ћ љњ…÷™,Є√Јі”¶ «мЎ÷µ‘цЉ”µƒ,”…”ЏЈі”¶ «ќь»»Јі”¶,ЄщЊЁ¶§G=¶§H-T¶§S,“™ єЄ√Јі”¶„‘ЈҐљш––,¶§G<0,‘т–и“™‘ЏЄяќ¬ѕ¬°£
(2)∆љЇв ±CO2µƒќп÷ µƒЅњ «0.76 mol,‘тѕыЇƒCO2 «(2-0.76) mol=1.24 mol,Ћщ“‘…ъ≥…CO «2.48 mol,“тіЋCO2ЇЌCOµƒ≈®ґ»Ј÷±р «0.38 mol/LЇЌ1.24 mol/L,Ћщ“‘K=c2(CO)/c(CO2)=1.242/0.38°÷4.0°£
(3)‘ціуCO2µƒ≈®ґ»,‘т∆љЇвѕт’эЈі”¶Јљѕт“∆ґѓ,µЂCO2µƒ„™їѓ¬ љµµЌ°£
(4)”…”ЏCO2µƒ≈®ґ»‘ціу,Ћщ“‘Јі”¶Ћў¬ Љ”њм,іпµљ∆љЇвµƒ ±ЉдЉх…ў°£…иѕыЇƒCO2 x mol,‘т…ъ≥…COќ™2x mol,Ћщ“‘”–K=c2(CO)/c(CO2)=x2/(2-0.5x)=4.0,љвµ√x=2 mol,ЊЁіЋњ…ї≠≥ц Њ“вЌЉ°£
(5)”…”ЏіЋ ±c2(CO)/c(CO2)=22/2=2<4.0,Ћщ“‘Јі”¶ѕт’эЈі”¶Јљѕт“∆ґѓ,‘т’эЈі”¶Ћў¬ іу”ЏƒжЈі”¶Ћў¬ °£

(1)“—÷™X°ҐY°ҐZќ™µЏ»э÷№∆Џ‘™ЋЎ,∆д‘≠„”µƒµЏ“ї÷ЅµЏЋƒµзјлƒ№»зѕ¬±н:
µзјлƒ№/kJ°§mol-1 | I1 | I2 | I3 | I4 |
X | 578 | 1 817 | 2 745 | 11 578 |
Y | 738 | 1 451 | 7 733 | 10 540 |
Z | 496 | 4 562 | 6 912 | 9 543 |
‘тX°ҐY°ҐZµƒµзЄЇ–‘і”іуµљ–°µƒЋ≥–тќ™°°°°°°°°°°°°(”√‘™ЋЎЈыЇ≈±н Њ),‘™ЋЎYµƒµЏ“їµзјлƒ№іу”ЏXµƒµЏ“їµзјлƒ№µƒ‘≠“т «°°
°°°£
(2)A°ҐB°ҐC°ҐD «÷№∆Џ±н÷–«∞10Ї≈‘™ЋЎ,Ћь√«µƒ‘≠„”∞лЊґ“јіќЉх–°°£Dƒ№Ј÷±р”лA°ҐB°ҐC–ќ≥…µз„”„№ эѕаµ»µƒЈ÷„”M°ҐN°ҐW,«“‘ЏM°ҐN°ҐWЈ÷„”÷–,A°ҐB°ҐC»э‘≠„”ґЉ≤…»°sp3‘”їѓ°£
ҐўA°ҐB°ҐCµƒµЏ“їµзјлƒ№”…–°µљіуµƒЋ≥–тќ™°°°°°°°°°°°°(”√‘™ЋЎЈыЇ≈±н Њ)°£
ҐЏM «Їђ”–°°°°°°°°Љьµƒ°°°°°°°°Ј÷„”(ћо°∞ЉЂ–‘°±їт°∞Ј«ЉЂ–‘°±)°£
ҐџN «“ї÷÷“„“Їїѓµƒ∆шће,«лЉт ц∆д“„“Їїѓµƒ‘≠“т:
°°°£
Ґ№WЈ÷„”µƒVSEPRƒ£–Ќµƒњ’Љдєє–Ќќ™°°°°°°°°,WЈ÷„”µƒњ’Љдєє–Ќќ™°°°°°°°°°£
ҐЁAB-÷–ЇЌB2Ј÷„”µƒ¶–Љь эƒњ±»ќ™°°°°°°°°°£
(3)E°ҐF°ҐG»э‘™ЋЎµƒ‘≠„”–т э“јіќ‘ціу,»э‘≠„”µƒЇЋЌвµƒ„оЌв≤гµз„”≈≈≤ЉЊщќ™4s1°£
ҐўE‘™ЋЎ„й≥…µƒµ•÷ µƒЊІћеґ—їэƒ£–Ќќ™°°°°°°°°(ћо„÷ƒЄ)°£
a.Љтµ•ЅҐЈљґ—їэb.ће–ƒЅҐЈљґ—їэ°°
c.ЅщЈљ„о√№ґ—їэd.√ж–ƒЅҐЈљ„о√№ґ—їэ
ҐЏF‘™ЋЎ‘Џ∆дїѓЇѕќп÷–„оЄяїѓЇѕЉџќ™°°°°°°°°°£
ҐџG2+µƒЇЋЌвµз„”≈≈≤Љ љќ™°° ,G2+ЇЌNЈ÷„”–ќ≥…µƒ≈дјл„”µƒљбєє љќ™°°°°°°°°°°°°°£
25 °ж ±,µзјл∆љЇв≥£ э:
»хЋбµƒїѓ—І љ | CH3COOH | HClO | H2CO3 |
µзјл∆љЇв≥£ э(25 °ж) | 1.8°Ѕ10-5 | 3.0°Ѕ | K1=4.3°Ѕ10-7 K2=5.6°Ѕ10-11 |
їЎірѕ¬Ѕ–ќ ћв:
(1)ќп÷ µƒЅњ≈®ґ»ќ™0.1 mol/Lµƒѕ¬Ѕ–Ћƒ÷÷ќп÷ :
a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3;
pH”…іуµљ–°µƒЋ≥–т «°°°°°°°°°°°°°°°°(ћо±аЇ≈)°£
(2)≥£ќ¬ѕ¬0.1 mol/LµƒCH3COOH»№“ЇЉ”ЋЃѕ° Ќєэ≥ћ÷–,ѕ¬Ѕ–±ніп љµƒ эЊЁ“їґ®±д–°µƒ «°°°°°°°°;
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)°§c(OH-) D.c(OH-)/c(H+)
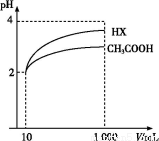
(3)ћеїэќ™10 mL pH=2µƒі„Ћб»№“Ї”л“ї‘™ЋбHXЈ÷±рЉ”ЋЃѕ° Ќ÷Ѕ1 000 mL,ѕ° Ќєэ≥ћpH±дїѓ»зЌЉ,‘тHXµƒµзјл∆љЇв≥£ э°°°°°°°°(ћо°∞іу”Џ°±°Ґ°∞µ»”Џ°±їт°∞–°”Џ°±)і„Ћбµƒ∆љЇв≥£ э;јн”… «°° °°,
ѕ° ЌЇу,HX»№“Ї÷–ЋЃµзјл≥цјіµƒc(H+)°°°°°°°°(ћо°∞іу”Џ°±°Ґ°∞µ»”Џ°±їт°∞–°”Џ°±)і„Ћб»№“Ї÷–ЋЃµзјл≥цјіµƒc(H+),јн”… «°° ;
(4)25 °ж ±,CH3COOH”лCH3COONaµƒїмЇѕ»№“Ї,»ф≤вµ√їмЇѕ“ЇpH=6,‘т»№“Ї÷–c(CH3COO-)-c(Na+)=°°°°°°°°°°°°°°°°°°°°°°°°(ћо„Љ»Ј э÷µ)°£
ЋЃ√Ї∆ш «“ї÷÷Єя–І∆шће»ЉЅѕ,∆д÷ч“™≥…Ј÷ «COЇЌH2,њ…”√ЋЃ’ф∆шЌ®єэ≥г»»µƒћЉ÷∆µ√:C (s)+H2O(g) CO (g)+H2 (g)°°¶§H=+131 kJ°§mol-1
CO (g)+H2 (g)°°¶§H=+131 kJ°§mol-1
(1)Tќ¬ґ»ѕ¬,ЋƒЄц»Ё∆ч÷–Њщљш––„≈…ѕ цЈі”¶,Єч»Ё∆ч÷–ћЉ„гЅњ,∆дЋыќп÷ µƒќп÷ µƒЅњ≈®ґ»Љ∞’э°ҐƒжЈі”¶Ћў¬ єЎѕµ»зѕ¬±нЋщ Њ°£«лћо–і±н÷–ѕа”¶µƒњ’Єс°£
»Ё∆ч ±аЇ≈ | c(H2O) /mol°§L-1 | c(CO) /mol°§L-1 | c(H2) /mol°§L-1 | v’э°Ґvƒж±»љѕ |
Ґс | 0.06 | 0.60 | 0.10 | v’э=vƒж |
Ґт | 0.06 | 0.50 | 0.40 | Ґў |
Ґу | 0.12 | 0.40 | 0.80 | v’э<vƒж |
Ґф | 0.12 | 0.30 | ҐЏ | v’э=vƒж |
Ґў°°°°°°°°°°°°°°°°°°°°°°,ҐЏ°° °£
‘ЏTќ¬ґ»ѕ¬Є√Јі”¶µƒїѓ—І∆љЇв≥£ эќ™°°°°°° °°°£
(2)Ѕн”–“їЄц»Ёїэњ…±дµƒ√№±’»Ё∆ч°£Їгќ¬Їг—єѕ¬,ѕт∆д÷–Љ”»л1.0 molћЉЇЌ1.0 molЋЃ’ф∆ш (H2O),ЈҐ…ъ…ѕ цЈі”¶,іпµљ∆љЇв ±,»Ё∆чµƒћеїэ±дќ™‘≠јіµƒ1.25 ±ґ°£∆љЇв ±ЋЃ’ф∆шµƒ„™їѓ¬ ќ™°°°°°°°°;ѕтЄ√»Ё∆ч÷–≤є≥дa mol ћЉ,ЋЃ’ф∆шµƒ„™їѓ¬ љЂ°°°°°°°° (ћо °∞‘ціу°±°Ґ°∞Љх–°°±їт°∞≤ї±д°±)°£
(3)‘Џ“їґ®ћхЉюѕ¬”√ЋЃ√Ї∆шƒ№Їѕ≥…Љ„іЉ:CO(g)+2H2(g) CH3OH(g)°°¶§H>0,ЄшЇѕ≥…Љ„іЉЈі”¶ћеѕµ÷–Ќ®»л…ўЅњCO‘т∆љЇв°°°°°°°° “∆ґѓ,Љх–°—є«њ‘т∆љЇв°°°°°°°°“∆ґѓ,љµµЌќ¬ґ»‘т∆љЇв°°°°°°°°°°°°°°°°“∆ґѓ(ћо°∞ѕт„у°±°Ґ°∞ѕт”“°±їт°∞≤ї°±)°£
CH3OH(g)°°¶§H>0,ЄшЇѕ≥…Љ„іЉЈі”¶ћеѕµ÷–Ќ®»л…ўЅњCO‘т∆љЇв°°°°°°°° “∆ґѓ,Љх–°—є«њ‘т∆љЇв°°°°°°°°“∆ґѓ,љµµЌќ¬ґ»‘т∆љЇв°°°°°°°°°°°°°°°°“∆ґѓ(ћо°∞ѕт„у°±°Ґ°∞ѕт”“°±їт°∞≤ї°±)°£