题目内容
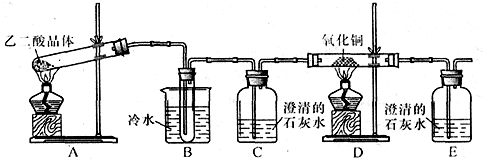
某研究性学习小组通过实验来探究乙二酸(又名草酸)受热分解的产物,他们设计的实验装置如图所示:
查阅资料可知:乙二酸晶体熔点100.1℃,草酸钙是难溶于水的白色固体;Cu2O能溶于稀硫酸,立即发生歧化反应生成Cu2+和Cu.
(1)实验过程中观察到C、E装置中的溶液均变浑浊,且D装置中黑色粉末变为红色,写出A中发生反应的化学方程式:______ CO↑+CO2↑+3H2O
【答案】分析:(1)根据乙二酸晶体加热生成一氧化碳、二氧化碳和水以及其性质进行解答;
(2)根据已二酸的沸点来确定除去乙二酸的方法,浓硫酸具有吸水性,可以将气体干燥,一氧化碳有毒,需要进行尾气处理;
(3)化学反应遵循强酸制弱酸的原理;
(4)金属铜和硫酸不反应,但是氧化亚铜可以和硫酸反应生成金属铜和硫酸铜,据此进行计算即可.
解答:解:(1)C、E装置中的溶液均变浑浊,且D装置中黑色粉末变为红色,说明乙二酸晶体加热生成一氧化碳、二氧化碳和水,反应的化学方程式:H2C2O4?2H2O CO↑+CO2↑+3H2O;
CO↑+CO2↑+3H2O;
故答案为:H2C2O4?2H2O CO↑+CO2↑+3H2O;
CO↑+CO2↑+3H2O;
(2)乙二酸可以和氢氧化钙发生反应,所以防止对检验分解产物CO2的干扰,要除去生成物中带出的乙二酸蒸汽,一氧化碳在还原氧化铜之前要将气体干燥,一氧化碳有毒,所以要进行尾气处理,
故答案为:除去生成物中带出的乙二酸蒸汽,防止对检验分解产物CO2的干扰;在C与D之间再装配一个盛浓硫酸的洗气瓶(或装有碱石灰的干燥管),将装置E中出来的气体引到酒精灯火焰上让其燃烧(或收集装置E中逸出的尾气);
(3)B的试管中是乙二酸,加入NaHCO3溶液,产生大量无色气体应该是二氧化碳,化学反应遵循强酸制弱酸的原理,所以酸性是乙二酸大于碳酸(或H2C2O4>H2CO3),故答案为:乙二酸大于碳酸(或H2C2O4>H2CO3);
(4)①金属铜和硫酸不反应,但是氧化亚铜可以和硫酸反应生成金属铜和硫酸铜,根据实验现象:溶液变为蓝色,则证明红色固体中含有Cu2O,故答案为:红色固体中含有Cu2O;
②设红色固体中氧化亚铜的物质的量是x,金属铜的物质的量为y,根据质量关系得:144x+64y=6.8,根据电子守恒,得出:2x+2y= ×(5-2),两式联立解得x=0.025mol,y=0.05mol,所以Cu的质量分数为:
×(5-2),两式联立解得x=0.025mol,y=0.05mol,所以Cu的质量分数为: ×100%=50%,故答案为:50%.
×100%=50%,故答案为:50%.
点评:本题是一道实验探究题,考查学生分析和解决问题的能力,注意平时只是的积累是解题的关键,综合性较强,难度大.
(2)根据已二酸的沸点来确定除去乙二酸的方法,浓硫酸具有吸水性,可以将气体干燥,一氧化碳有毒,需要进行尾气处理;
(3)化学反应遵循强酸制弱酸的原理;
(4)金属铜和硫酸不反应,但是氧化亚铜可以和硫酸反应生成金属铜和硫酸铜,据此进行计算即可.
解答:解:(1)C、E装置中的溶液均变浑浊,且D装置中黑色粉末变为红色,说明乙二酸晶体加热生成一氧化碳、二氧化碳和水,反应的化学方程式:H2C2O4?2H2O
 CO↑+CO2↑+3H2O;
CO↑+CO2↑+3H2O;故答案为:H2C2O4?2H2O
 CO↑+CO2↑+3H2O;
CO↑+CO2↑+3H2O;(2)乙二酸可以和氢氧化钙发生反应,所以防止对检验分解产物CO2的干扰,要除去生成物中带出的乙二酸蒸汽,一氧化碳在还原氧化铜之前要将气体干燥,一氧化碳有毒,所以要进行尾气处理,
故答案为:除去生成物中带出的乙二酸蒸汽,防止对检验分解产物CO2的干扰;在C与D之间再装配一个盛浓硫酸的洗气瓶(或装有碱石灰的干燥管),将装置E中出来的气体引到酒精灯火焰上让其燃烧(或收集装置E中逸出的尾气);
(3)B的试管中是乙二酸,加入NaHCO3溶液,产生大量无色气体应该是二氧化碳,化学反应遵循强酸制弱酸的原理,所以酸性是乙二酸大于碳酸(或H2C2O4>H2CO3),故答案为:乙二酸大于碳酸(或H2C2O4>H2CO3);
(4)①金属铜和硫酸不反应,但是氧化亚铜可以和硫酸反应生成金属铜和硫酸铜,根据实验现象:溶液变为蓝色,则证明红色固体中含有Cu2O,故答案为:红色固体中含有Cu2O;
②设红色固体中氧化亚铜的物质的量是x,金属铜的物质的量为y,根据质量关系得:144x+64y=6.8,根据电子守恒,得出:2x+2y=
 ×(5-2),两式联立解得x=0.025mol,y=0.05mol,所以Cu的质量分数为:
×(5-2),两式联立解得x=0.025mol,y=0.05mol,所以Cu的质量分数为: ×100%=50%,故答案为:50%.
×100%=50%,故答案为:50%.点评:本题是一道实验探究题,考查学生分析和解决问题的能力,注意平时只是的积累是解题的关键,综合性较强,难度大.

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案
相关题目
 某研究性学习小组通过查阅资料发现,CuSO4溶液与NaOH溶液反应生成的沉淀中除Cu(OH)2外,还有碱式硫酸铜[化学式可表示为xCuSO4?yCu(OH)2].为了加以验证,小组成员进行了如下实验:
某研究性学习小组通过查阅资料发现,CuSO4溶液与NaOH溶液反应生成的沉淀中除Cu(OH)2外,还有碱式硫酸铜[化学式可表示为xCuSO4?yCu(OH)2].为了加以验证,小组成员进行了如下实验:

 查阅资料可知:乙二酸晶体(H2C2O4·2H2O)熔点100.1 ℃,草酸钙是难溶于水的白色固体;Cu2O能溶于稀硫酸,立即发生歧化反应生成Cu2+和Cu。
查阅资料可知:乙二酸晶体(H2C2O4·2H2O)熔点100.1 ℃,草酸钙是难溶于水的白色固体;Cu2O能溶于稀硫酸,立即发生歧化反应生成Cu2+和Cu。 进一步探究:
进一步探究: