题目内容
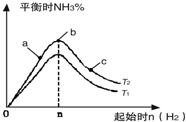
7.在一定温度和压强的密闭容器中,将平均分子质量为8.5的N2和H2混合,随后在一定条件下合成氨,当反应达到平衡时测得混合气体的平均分子质量为10.(1)反应前N2和H2的体积比为1:3;
(2)氮气的平衡转化率;
(3)平衡混合气中氨气的体积分数.
分析 (1)平均分子质量为8.5的N2和H2混合,设N2和H2的物质的量分别为x、y,则$\frac{28x+2y}{x+y}$=8.5;
由(1)可知N2和H2的物质的量为1:3,设物质的量为a、3a,达到平衡时测得混合气体的平均分子质量为10,平衡后物质的量为$\frac{28a+6a}{10}$=3.4a,则
N2+3H2 ?2NH3
开始(mol):a 3a 0
变化(mol):n 3n 2n
平衡(mol):a-n a-3n 2n
则a-n+a-3n+2n=3.4a,解得n=0.3a,以此解答(2)、(3).
解答 解:(1)平均分子质量为8.5的N2和H2混合,设N2和H2的物质的量分别为x、y,则$\frac{28x+2y}{x+y}$=8.5,解得x:y=1:3,
故答案为:1:3;
由(1)可知N2和H2的物质的量为1:3,设物质的量为a、3a,达到平衡时测得混合气体的平均分子质量为10,平衡后物质的量为$\frac{28a+6a}{10}$=3.4a,则
N2+3H2 ?2NH3
开始(mol):a 3a 0
变化(mol):n 3n 2n
平衡(mol):a-n a-3n 2n
则a-n+a-3n+2n=3.4a,解得n=0.3a,
(2)氮气的平衡转化率为$\frac{0.3a}{a}$×100%=30%,答:氮气的平衡转化率为30%;
(3)平衡混合气中氨气的体积分数为$\frac{2×0.3a}{3.4a}$×100%=17.6%,答:平衡混合气中氨气的体积分数为17.6%.
点评 本题考查化学平衡的计算,为高频考点,把握反应前后的物质的量关系、化学平衡三段法为解答的关键,侧重分析与计算能力的考查,注意平均相对分子质量的应用,题目难度不大.


| A. | 该硫酸试剂的物质的量浓度为18.4 | |
| B. | 该硫酸与等体积的水混合所得溶液的质量分数小于49% | |
| C. | 配制50.0mL4.6mol•L-1的稀硫酸需取该硫酸12.5mL | |
| D. | 2.4gMg与足量的该硫酸反应得到H2 的体积为2.24L |
| PCl3(g) | Cl2(g) | PCl5(g) | |
| 初始浓度/(mol/L) | 2.0 | 1.0 | 0 |
| 平衡浓度/(mol/L) | c1 | c2 | 0.4 |
| A. | 10 min内,v(Cl2)=0.04 mol/(L•min) | |
| B. | 升高温度,反应的平衡常数减小,则平衡时PCl3的转化率变大 | |
| C. | 当容器中Cl2为1.2 mol时,反应达到平衡 | |
| D. | 平衡后移走2.0 mol PCl3和1.0 mol Cl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol/L |
当反应达到平衡后,反应放出的热量为Q1 kJ,物质X的转化率为α;若平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)化学计量数a的值为1.
(2)下列说法中能说明该反应达到了化学平衡状态的是AC.
A.容器内压强一定 B.容器内气体的密度一定C.容器内Z分子数一定 D.容器内气体的质量一定
(3)温度维持T℃不变,若起始时向容器M中加入的物质的量如下列各项,则反应达到平衡后放出的热量仍为Q1 kJ的是A (稀有气体不参与反应).
A.2mol X、1mol Y、1mol Ar B.a mol Z、1mol W
C.1mol X、0.5mol Y、0.5a mol Z、0.5mol W D.2mol X、1mol Y、1mol Z
(4)温度维持T℃不变,若起始时向容器M中加入4mol X和6mol Y,若达到平衡时容器内的压强减小了10%,则反应中放出的热量为QkJ.
(5)温度维持T℃不变,若在一个和原容器体积相等的恒压容器N 中,加入2mol X和1mol Y发生如上反应并达平衡,则N(选填M或N)容器中的反应先达到平衡状态,容器中X的质量分数M>N(选填>、<、=符号).
(6)已知:该反应的平衡常数随温度的变化如下表:
| 温度/℃ | 200 | 250 | 300 | 350 |
| 平衡常数K | 9.94 | 5.2 | 1 | 0.5 |
| IA | 0 | ||||||||
| 1 | IIA | IIIA | IVA | VA | VIA | VIIA | |||
| 2 | ① | ② | Ne | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ |
(1)①元素符号是C.
(2)元素⑤的原子结构示意图是
 .
.(3)③、④两种元素的金属性强弱关系:③>④(填“>”或“<”).
(4)元素②、⑥的气态氢化物的稳定性较强的是H2O(填化学式).