题目内容
如图所示装置工作一段时间后,原电解质溶液的浓度基本上保持不变的是
[
]

 习题精选系列答案
习题精选系列答案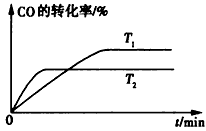
①该反应的焓变△H____(填“>”、“<”或 “=”)0。
②T1和T2温度下的平衡常数大小关系是K1____ (填“>”、“<”或“=”)K2。
③若容器容积不变,下列措施可增加甲醇产率的是____
a.升高温度
b.将CH3OH(g)从体系中分离出来
c.使用合适的催化剂
d.充入He,使体系总压强增大
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H=-a kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H=-b kJ/mol
③H2O(g)=H2O(l) △H=-c kJ/mol
则CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H =____kJ/mol。
(4)已知甲醇燃料电池的工作原理如图所示。
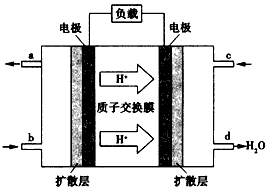
②该电池正极的电极反应式为:________________。
③工作一段时间后,当6.4g甲醇完全反应生成CO2 时,有____NA个电子发生转移。
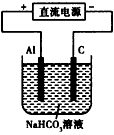
(5)用上述电池作电源,用如图所示 装置进行实验,发现实现过程中,溶液逐渐变浑浊,原因是(用相关的电极反应式和离子方程式表示):_____________________
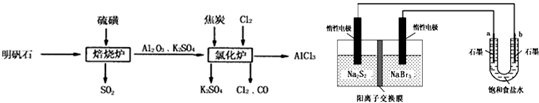
 金属铝是应用广泛的金属之一,在工农业生产中有着广泛的应用,对金属制品进行抗腐蚀处理,可延长其使用寿命.
金属铝是应用广泛的金属之一,在工农业生产中有着广泛的应用,对金属制品进行抗腐蚀处理,可延长其使用寿命. CH3OH(g)。
CH3OH(g)。
